Окисление - катион
Cтраница 3
При восстановлении катионов или окислении анионов предельный ток в присутствии фона становится вдвое меньше предельного тока без фона, а при восстановлении анионов или окислении катионов - в два раза больше. Это объясняется тем, что в первых двух случаях величины / пред, мигр и гдиф имеют одинаковый знак, а в двух последних jMlirp имеет отрицательный знак, потому что в случае катодного восстановления анионов и анодного окисления катионов электрическое поле отталкивает реагирующие на электроде вещества. [31]
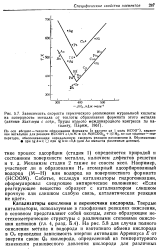
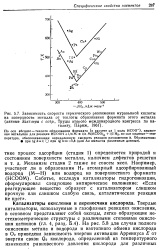
Способность к предпочтительному связыванию центрального катиона металла с тем или иным лигандом ( Н2О, - ОН, - О -) Иоргенсен [167] пытается предсказать, рассматривая степень окисления центрального катиона z и рН раствора ( рис. VI. Отметим, однако, что такой подход не учитывает размеров катионов, что может оказаться существенным при сравнении металлов одной степени окисления. [32]
Анализ показывает, что не существует однозначной зависимости ( линейной или нелинейной) между Eg Мо и степенью оки сления поскольку и зменения Egj могут быть не связаны с изменением степени окисления катиона. В каждом случае для определения степени окисления Мо необходима совокупность методов. [33]
Электрокристаллизация включает процессы катодного или анодного электроосаждения; в свою очередь последний процесс включает анодное образование окислов, гидроокисей и солей металлов на самом электроде, а также фазовые изменения, происходящие в анодных осадках, когда электронный переход приводит к окислению катионов. Феноменологически к этим процессам относятся осаждение металла, электрохимия первичных и вторичных электродов химических источников тока, за исключением газовых электродов, и основные процессы коррозии. При изучении кинетики этих процессов возникают разного рода проблемы, которые отличаются от проблем, изложенных в остальных разделах данной главы, поскольку невозможно рассматривать гетерогенную электродную реакцию как реакцию, скорость которой одинакова по всей поверхности электрода и к которой применим общий подход, развитый в разд. [34]
Окисление отдельных катионов в кристаллической решетке минерала влияет на выщелачивание, даже когда степень окисления извлекаемого элемента не изменяется. Так, окисление катионов Fe2 и Мп2 влияет на характер изменения поверхности вольфрамита при выщелачивании вольфрама щелочью и, следовательно, на скорость этого процесса, которая поэтому зависит от парциального давления кислорода. [35]
Вольфрамит, не имеющий признаков интенсивного окисления поверхности, практически не разлагается щелочными растворами в отсутствие кислорода. С) также требуется окисление катионов группы А - Fe2, Мп2, так как при полном вытеснении кислорода из автоклава и раствора минерал не разлагается. Ионы решетки на границе раз - Дела твердой и жидкой фаз окисляются с образованием пероксид-ных ионов, в растворах, как и в случае других окислительных реакций, обнаруживаются пероксиды. [36]
Рассмотрим экспериментальные данные по влиянию ионных ПАОВ на скорость электрохимических реакций, кинетика которых определяется медленностью переноса электрона. В этом плане наиболее удобными являются реакции восстановления анионов и окисления катионов. Во-первых, влияние - потенциала на скорость этих реакций наиболее велико, поскольку эффект от изменения поверхностной концентрации реагирующей частицы суммируется с эффектом от действия i-потенциала на энергию активации. Отметим, что для реакции восстановления катионов влияние i i -потенциал а на эти два параметра электрохимических реакций направлено в противоположные стороны, и суммарный фгэффект оказывается существенно меньше. Во-вторых, для реакций восстановления анионов в присутствии органических катионов тргэффект и влияние других ингибирующих факторов ( блокировка поверхности, работа по преодолению межмолекулярных взаимодействий в адсорбционном слое и др.) оказывают противоположное действие на скорость процесса. Опять-таки в случае разряда катионов изменение - потенциала при адсорбции органических катионов в сторону менее отрицательных значений1 складывается с ингибирующими эффектами и выделить г - эффекг не представляется возможным. [37]
B окислах металлов с частично заполненными а-ободочкамк - fe 03, CoO Со50 СцО - - состояния у потолка валентной зоны принадлежат oi - состояниям катионов, 2р - зоны 0 расположены ниже в ряде случаев энергетически перекрываясь с а-зонами и проводимость осуществляется переносом электрона по состояниям а-характера Д, 2 8 /, Вследствие описанных особенностей энергетического строения в окислах с конфигурациями катионов о - или о. Си-зоне в форме катионов, имеющих степень окисления на единицу выше степени окисления катиона Е данном окисле, электроны в а-зоне проводимости в форме. Анион-радикалы 0 - обладают высокой реакционной способностью в реакциях окисления. [38]
Твердые катализаторы, используемые в газофазных реакциях окисления, в основном представляют собой оксиды, легко образующие не-стехиометрические структуры с различными степенями окисления катионов ( гл. [40]
Твердые катализаторы, используемые в газофазных реакциях окисления, в основном представляют собой оксиды, легко образующие не-стехиометрические структуры с различными степенями окисления катионов ( гл. [42]
Окисляющее действие брома уже было рассмотрено. Однако в принципе ( возможно, что окисление катиона талоида происходит за счет отрыва от окисляемой молекулы гидрид-иона. Вероятно, необходимы дополнительные исследования в этой области. [43]
Основным методом отделения и концентрирования следовых количеств веществ является экстракция ( см. гл. Многие элементы можно перевести в соединения, малорастворимые в воде, но хорошо растворимые в органических растворителях. Применяя различные лиганды для комплексообразования, меняя рН водного раствора, степень окисления экстрагируемых катионов и применяя различные растворители для экстракции, можно варьировать степень извлечения и концентрирования. В идеальном случае извлекаемый элемент при встряхивании ( для увеличения поверхности раздела фаз с целью ускорения достижения равновесного состояния) полностью переходит в органическую фазу, в то время как мешающие определению элементы остаются в водной фазе. Таким образом удается отделить следовые количества элементов от больших количеств других элементов ( матрицы) и сконцентрировать их. [44]
Электролиты способны разлагаться под действием электрического тока. Происходящие при этом процессы называют электролизом. Для практического осуществления процесса электролиза в раствор или расплав электролита погружают два электрода из внешней цепи. Один электрод имеет отрицательный заряд, на нем должен происходить процесс окисления катионов. Напомним, что электрод, на котором происходит процесс окисления катионов, называют катодом. Второй электрод заряжают положительно. На этом электроде должно происходить восстановление анионов. При замыкании внешней цепи отрицательно заряженные анионы движутся к аноду, положительно заряженные катионы - к катоду. [45]
Страницы: 1 2 3 4