Окисление - муравьиная кислота
Cтраница 1
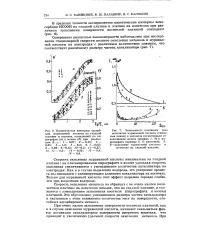
Окисление муравьиной кислоты в 1М растворе H2S04 на платиновом электроде, так же как и окисление щавелевой кислоты, сопровождается адсорбцией самой кислоты и промежуточных веществ. Окисление ингибируется хемосорбированным кислородом. Хроно-потенциометрическая кривая окисления наблюдается [241] при потенциалах положительнее 0 9 В ( нас. [1]
Скорость окисления муравьиной кислоты минимальна на гладкой платине; на платинированном пирографите и золоте удельная скорость окисления увеличивается с уменьшением количества катализатора на электродах. Как и в случае выделения водорода, это ускорение процесса мы связываем с активирующим влиянием катализатора на носитель. Только для муравьиной кислоты этот эффект выражен гораздо слабее, чем при выделении водорода. [3]
При окислении муравьиной кислоты получен газ, который пропустили через избыток раствора гидроксида кальция. [4]
При окислении муравьиной кислоты получается угольная кислота, которая разлагается на углекислый газ и воду. [5]
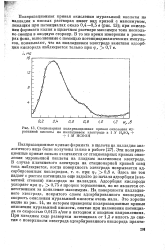 |
Стационарная поляризационная кривая окисления муравьиной кислоты на палладиевом электроде в 1 N H3S04 1 М НСООН. [6] |
Поляризационная кривая окисления муравьиной кислоты на палладии в кислых растворах имеет вид кривой с максимумом, лежащим при потенциалах около 0 4 - 0 5 в ( рис. 13); при окислении формиата калия в щелочном растворе максимум тока несколько смещен в анодную сторону. [7]
При изучении окисления муравьиной кислоты Шилов нашел, что окисление недисеоциированной кислоты проходит в 104 раз медленнее, чем формиат иона. Изучая реакцию при разных киелотностях, он нашел, что при рН 5 - Ю окисляющим агентом является окись хлора. [8]
Что происходит при окислении муравьиной кислоты марганцевокислым калием и аммиачным раствором окиси серебра. [9]
Количество образовавшейся при окислении муравьиной кислоты зависит от характера анализируемого сахара: альдогексозы дают 5 молекул муравьиной кислоты, пентозы и метилпентозы - 4 молекулы, а кетогексозы - 3 молекулы. Так как при окислении одной молекулы сахара образуется большее количество молекул титруемой муравьиной кислоты, то приведенный метод отличается большей чувствительностью и точностью по сравнению с методами, основанными на определении альдегидной или кетонной групп. [10]
Исследование процесса адсорбции и окисления муравьиной кислоты показывает, что уже при работе на гладком платиновом электроде мы часто сталкиваемся с наложением на собственно электрохимический процесс окисления каталитического процесса разложения муравьиной кислоты. [12]
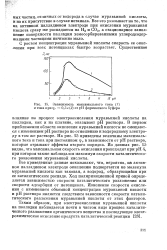 |
Зависимость максимального тока ( 1 и тока при фг 0 3 в ( 2 от рН формиатного буфера. [13] |
В первом приближении области окисления муравьиной кислоты не смещаются с изменением рН раствора по отношению к водородному электроду в том же растворе. На рис. 15 приведены величины максимального тока и тока при постоянном срг в зависимости от рН раствора, которые отражают эффекты второго порядка. Из данных рис. 15 видно, что максимальная скорость окисления происходит при рН 4, при котором также наблюдался максимум скорости каталитического разложения муравьиной кислоты. [14]
Другие явления наблюдаются при окислении муравьиной кислоты на активном палладиевом электроде. Уже при введении такого электрода в контакт с концентрированным раствором муравьиной кислоты без тока происходит бурное разложение муравьиной кислоты на Н2 и С02 даже при комнатной температуре. [15]
Страницы: 1 2 3 4