Окисление - муравьиная кислота
Cтраница 2
В основе определения лежит реакция окисления муравьиной кислоты перманганатом калия в слабо щелочной среде. [16]
Количество перманганата калия, идущее на окисление муравьиной кислоты, эквивалентно ее содержанию в растворе. [17]
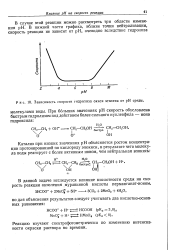 |
Зависимость скорости гидролиза окиси этилена от рН среды. [18] |
В данной задаче исследуется влияние кислотности среды на скорость реакции окисления муравьиной кислоты перманганат-ионом. [19]
Его действие было изучено количественно путем определения углекислоты, образующейся при окислении муравьиной кислоты. Это действие возрастает с повышением температуры до 38 - 40, а затем начинает падать и при 65 становится едва заметным. По отношению к содержанию пероксидазы все исследованные органы располагаются в следующий ряд: печень, почки, селезенка, легкие, поджелудочная железа, лимфатическая железа, мышцы, мозг, яички, собачьи мышцы, тимус, надпочечники, щитовидная железа, мышцы кролика. В присутствии гидроперекиси этила пероксидаза из печени окисляет муравьиную кислоту в нейтральной среде энергичнее, чем в кислой. Авторы склонны считать, что пероксидаза, которая активирует перекись водорода при окислении муравьиной кислоты, тождественна с той, которая действует при окислении иодистоводородной кислоты. [20]
При очень малом заполнении поверхности носителя платиной, как и в случае окисления муравьиной кислоты, начинает сказываться фактор активации катализатором поверхности инертного носителя, что приводит к увеличению удельной скорости окисления метанола. [21]
Следовательно, единственной реакцией, действительно имеющей место, является реакция восстановления шестивалентного урана и окисления муравьиной кислоты. [22]
По разности затраченных объемов растворов перманган-ата калия и тиосульфата натрия определяют необходимое количество перманганата калия на окисление муравьиной кислоты. Он эквивалентен ее содержанию в растворе. [23]
Многие кинетические закономерности для этого смешанного случая будут полностью аналогичны кинетическим закономерностям, наблюдающимся для процесса окисления муравьиной кислоты на каталитически неактивном электроде. [24]
Те же авторы подвергли затем более детальному исследованию вещество ( впервые найденное в тканях Бателли117), активирующее перекись водорода при окислении муравьиной кислоты. [25]
Образование таких продуктов, как СО, С02 и СаНв принципиально может быть следствием как непосредственного разрушения молекулы ацетона, так и окисления уксусной и муравьиной кислоты. Поэтому интересно было выяснить поведение ацетата и формиата натрия на аноде при электролизе щелочного раствора. [26]
Однако если принять во внимание, что растительная пероксидаза, энергично активирующая перекись водорода при окислении иодистоводородной кислоты, не оказывает никакого влияния на окисление муравьиной кислоты, то имеется большее основание предполагать, что в этом случае мы имеем дело с двумя различными пероксидазами. [27]
Последний затем фиксируется, по-видимому, в ходе тех же реакций, что и при фотосинтезе, хотя в этом случае вместо световой энергии используется энергия, высвобождаемая при окислении муравьиной кислоты. [28]
Обезвоженную уксусную кислоту с небольшим содержанием муравьиной кислоты отбирают в жидком виде с верхних тарелок ректификационной колонны 32, охлаждают в холодильнике 34 и обрабатывают в окислителе 35 перманганатом калия для окисления муравьиной кислоты. Уксусную кислоту с небольшим содержанием перманганата калия собирают в бак 36, в котором доходит до конца реакция окисления. [29]
Из литературных данных [9, 10] известно, что в щелочной среде уксусная кислота даже на платиновом аноде не подвергается окислению. Окисление муравьиной кислоты в щелочных растворах не описано; в кислой среде па платиновом аноде она окисляется до С02 и Н2 почти со 10096-пым выходом по току. [30]
Страницы: 1 2 3 4