Окисление - ниобий
Cтраница 1
Окисление ниобия широко изучалось [15, 22, 53, 55, 71, 78, 129], поскольку малая стойкость его по отношению к кислороду, несомненно, является одним из самых серьезных недостатков. Этот недостаток должен быть устранен, чтобы ниобий можно было применять при высоких температурах в тех случаях, где полезны его другие превосходные свойства. В следующих разделах дано краткое описание некоторых способов защиты ниобия. [1]
 |
Прирост веса в функции времени. [2] |
Окисление ниобия и тантала при температурах от 300 до 500 на начальных стадиях идет главным образом путем растворения кислорода. [3]
Скорость окисления ниобия в интервале темп-р 200 - 400 подчиняется параболич. Повышение темп-ры нагрева выше 400 увеличивает скорость окисления ниобия и, начиная с темп-ры 700, окисление его имеет линейную зависимость от времени. На поверхности ниобия при этих темп - pax образуется пористый окисленный слой пятиокиси ниобия ( Nb2O5), легко отделяющийся от металлич. Пяти-окись ниобия представляет собой белое кристаллич. По данным различных авторов, пятиокись ниобия существует в четырех модификациях с ог-ранич. [4]
Полученные данные об окислении ниобия, растворенного в железе, показывают, что этот элемент практически полностью переходит из металла в окислительный шлак. Установленная количественная зависимость показателя распределения ниобия от температуры относится к случаю, когда активность закиси железа в шлаке равна единице. Это позволяет подойти к расчету равновесия реакции окисления ниобия в случае реальных шлаков и оценить возможные потери ниобия при введении его лигатуры. [5]
Тот же результат дает окисление ниобия, NbO или NbO2 при максимальной температуре 1200 - 1300 С. При охлаждении H - Nb2Os оказывается кинетически устойчивым. [6]
Таким образом, производные низких степеней окисления ниобия и тантала в основном относятся к соединениям кластерного типа. [7]
Несмотря на принятые меры по предотвращению окисления ниобия, нам не удалось получить растворы с отношением в них трехвалентного ниобия к пятивалентному, равным 2: 1, как в исходной соли 3.67. Вероятно, в растворе происходит медленное окисление ниобия серной кислотой. Растворы, насыщенные солью 3.67, после длительного стояния издают запах сероводорода. [8]
На рис. 12 представлены данные по окислению ниобия и тантала и сопоставлены с данными по окислению титана и циркония. Несмотря на то, что температуры реакций различны, ясно видно, что тантал окисляется быстрее титана, но медленнее, чем ниобий и цирконий. [9]
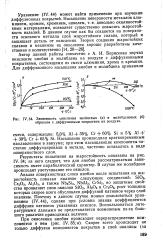 |
Зависимость окисления ниобиевых ( а и молибденовых ( б образцов с диффузионным покрытием на воздухе. [10] |
Автор данной работы совместно с А. И. Борисенко изучил окисление ниобия и молибдена на воздухе с диффузионными покрытиями, состоящими из смеси алюминия, хрома и кремния. [11]
Как сообщалось [552], влага в воздухе ускоряет окисление ниобия при 400 С, замедляет его при 600 С и не оказывает почти никакого влияния при температурах выше 800 С. [12]
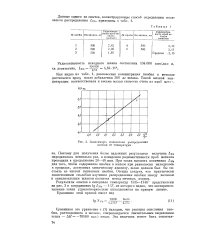 |
Зависимость показателя распределения ниобия от температуры. [13] |
Сравнивая это уравнение с ( 1) находим, что реакция окисления ниобия, растворенного в железе, сопровождается значительным выделением тепла - Д Я - 70500 кал / г - атом. [14]
На рис. 13 даны возведенные в квадрат величины приращения веса при окислении ниобия при 325 и 7 6 см О. Данные хорошо укладываются на прямую линию, что свидетельствует о параболической зависимости между приращением веса и временем, а следовательно, о замедлении скорости реакции, хотя для первоначальных стадий реакции наблюдается некоторое отклонение. Подобное соответствие наблюдаемого замедления окисления параболическому уравнению было найдено и в случае окисления тантала. [15]
Страницы: 1 2 3 4