Окисление - ниобий
Cтраница 2
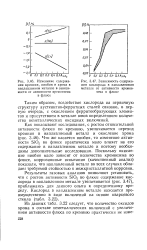
В бюллетене одной из фирм ( Fansteel Metallurgical Corporation) [33] опубликованы сведения о степени окисления ниобия после контакта в течение 20 час. Образующийся окисел, по этим же данным, плотно пристает к поверхности металла и, если только не повышать температуру, препятствует дальнейшему окислению. [16]
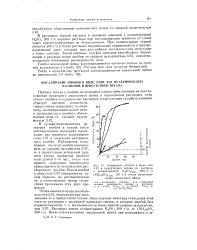 |
Осаждение ниобия в виде соли в присутствии титана из раствора. [17] |
В сульфатноаммонийных растворах ниобия и титана после восстановления последних происходит два процесса: высаливание соли 3.67 и окисление растворенного ниобия. Наблюдения показывают, что если ниобий восстановить до средней валентности 3.67, то в присутствии небольшой примеси титана осаждение двойной соли длится 5 - 6 час. [18]
С целью иллюстрации применения этого метода к изучений окисления металлов мы рассмотрим некоторые из недавно прове денных нами исследований по окислению ниобия и тантала [ 30J, Высокие точки плавления, а также прочие ценные физические и химические свойства делают эти металлы пригодными для пример нения как в научных целях, так и в промышленности. Ниобий и тантал химически устойчивы по отношению к коррозии газами и жидкостями при комнатной температуре. Однако при температ турах порядка 250 и выше эти металлы легко реагируют с кислородом и водородом. [19]
Весьма важным, мне кажется, пособием для того, чтобы разобраться с рассматриваемыми металлами, должно служить изучение низших степеней окисления Ниобия и Тантала, очевидно тесно сближенных с церитовыми и гадо-линитовыми металлами по месту в природе и в системе элементов. [20]
Скорость окисления этого сплава изменяется по параболическому закону и составляет при 1100 7 8 - 10 - 5 г / см - сек1, превышая в 100 раз скорость окисления ниобия при той же температуре. [21]
В табл. 7 приведены определенные по уравнению ( 1) константы скорости К, а также энергии активации Е, энтропии Д5 и свободные энергии д / 7 для процессов окисления ниобия и тантала. [22]
Ниобий активно взаимодействует с кислородом, азотом, водородом и другими газами. Окисление ниобия, например, начинается уже при температурах 200 - 250 С. Ниобий может растворять кислород в жидком и в твердом состояниях. [23]
Что же касается ниобия, то изменение активности SiO2 во флюсе практически мало влияет на его содержание в наплавленном металле и поэтому необходимы дополнительные исследования. Поскольку окисление ниобия мало зависит от количества кремнезема во флюсе, коррозионные испытания ( качественный анализ) показали, что наплавленный металл во всех случаях обладает требуемой стойкостью к межкристаллитнои коррозии. [25]
Именно поэтому окислению ниобия в последнее время был посвящен ряд исследований. Так как по своему сопротивлению окислению ниобий очень схож с танталом, два этих металла рассматриваются здесь вместе. Наблюдавшиеся при различных температурах зависимости окисление - время носят несколько сложный характер [706], но соответствующие экспериментальные данные, полученные разными исследователями, очень хорошо согласуются между собой. [26]
Изображенная на рис. 14 зависимость представляет собой прямую линию, по наклону которой вычислена энергия активации для окисления тантала, равная 27 400 кал / моль. Подобный анализ данных по окислению ниобия дает энергию активации 22 800 кал / моль. [27]
Давление кислорода изменялось в 50 раз - от 7 6 до 0 15 см. Простой зависимости между давлением и скоростью реакции не обнаружено. Подобные результаты получены и для окисления ниобия в том же самом интервале давлений. Очевидно, что линейное или пропорциональное квадратному корню из давления изменение скорости реакции не имеет места. Мы делаем вывод, что незначительное изменение скорости окисления при возрастании давления в 10 раз ( рис. 15) свидетельствует о том, что стадией, определяющей скорость этой реакции, является какой-то диффузионный процесс, возможно - диффузия ионов ниобия или тантала через окис-ную пленку. [28]
Из таблицы видно, что термообработка тоже приводит к некоторому снижению пластичности. По-видимому, снижение пластичности вызывается некоторым окислением ниобия в вакууме порядка 5 - Ю 5 мм. Ниобий с покрытием во всех случаях имеет меньшую пластичность, чем ниобий без покрытия, но прошедший точно такую же термообработку. С целью выяснения влияния диффузии металла покрытия на свойства основного металла были проведены длительные отжиги при высоких температурах. [29]
Затем происходит переход к стадий линейного окисления. Влажность кислорода не оказывает влияния на скорость окисления ниобия. [30]
Страницы: 1 2 3 4