Окисление - ниобий
Cтраница 3
Скорость окисления ниобия в интервале темп-р 200 - 400 подчиняется параболич. Повышение темп-ры нагрева выше 400 увеличивает скорость окисления ниобия и, начиная с темп-ры 700, окисление его имеет линейную зависимость от времени. На поверхности ниобия при этих темп - pax образуется пористый окисленный слой пятиокиси ниобия ( Nb2O5), легко отделяющийся от металлич. Пяти-окись ниобия представляет собой белое кристаллич. По данным различных авторов, пятиокись ниобия существует в четырех модификациях с ог-ранич. [31]
Известны более поздние сообщения о влиянии влаги. Как установил Иною [552], влага повышает скорость окисления ниобия три 400 С, снижает ее при 600 С и не оказывает никакого влияния при более высоких температурах. По наблюдениям Бриттона и Брайта [553], 80 % - ная влажность повышает скорость окисления твердого олова на воздухе на 50 %, а Фоли и Гуаре [554] удалось добиться лучшей воспроизводимости экспериментальных результатов по определению скорости окисления сплавов железа с никелем в температурном интервале от 600 до 1000 С IB результате замены лабораторной атмосферы надлежащей смесью кислорода с азотом. [32]
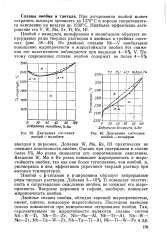 |
Диаграмма состояния ниобий - молибден.| Диаграмма состояния ниобий - вольфрам. [33] |
Ниобий с р-титаном и р-цирконием образует непрерывные ряды твердых растворов. Добавка 5 - 10 % Ti повышает пластичность и сопротивление окислению ниобия, но снижает его жаропрочность. Введение циркония и гафния, наоборот, повышает жаропрочность ниобия. [34]
Глубина общего силицированного слоя осталась примерно такой же, как и до нагревания ( 60 мк), но часть его глубиной 7 - 10 мк была израсходована при окислении ниобия и образовании на его поверхности кремнезема. [35]
Из-за нерастворимости оксидов в степени окисления ( V) и отсутствия промежуточных степеней окисления химия ниобия и тантала в растворах практически отсутствует. Ниобий ( III), по-видимому, образуется при восстановлении ниобия ( V) цинком и устойчив на холоду в отсутствие воздуха; нагревание раствора приводит к переходу ниобия в осадок, содержащий оксиды с различными степенями окисления ниобия. [36]
ТаОу и TaOz - окиснометаллические фазы, составы которых точно не установлены. Реакция окисления ниобия описывается аналогичной схемой. [37]
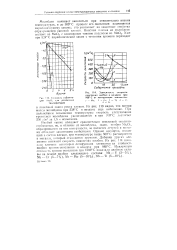 |
Зависимость скорости окисления ниобия в воздухе при С от легирующих элементов. [38] |
Ниобий также обладает сравнительно невысокой окалино-стойкостыо, по, в отличие от молибдена, окись ниобия МЬ2О, образующаяся на его поверхности, не является летучей и поэтому обладает защитными свойствами. Однако кислород, входящий в состав пленки, при температуре выше 500 С растворяется в металле, который становится хрупким. Добавки других элементов снижают скорость окисления ниобия. На рис. 114 показано влияние некоторых легирующих элементов на стойкость ниобия против окисления в воздухе при 980 С. [39]
Ниобий также обладает сравнительно невысокой окалино-стойкостью, но, в отличие от молибдена, окись ниобия Nb2O5, образующаяся на его поверхности, не является летучей и поэтому обладает защитными свойствами. Однако кислород, входящий в состав пленки, при температуре выше 500 С растворяется в металле, который становится хрупким. Добавки других элементов снижают скорость окисления ниобия. На рис. 114 показано влияние некоторых легирующих элементов на стойкость ниобия против окисления в воздухе при 980 С. [40]
Пористость в окалинах возникает вследствие ряда причин. Образованию непрерывной окалины может препятствовать сам процесс роста, например, в том случае, когда основная часть продуктов реакции накапливается на отдельных кристаллитах промежуточных продуктов. Такой механизм имеет место при окислении ниобия [4,53] и тантала [3] при температурах ниже 600 и 800 соответственно. [41]
Совпадает ли это с устойчивой степенью окисления ниобия и тантала. [42]
Полученные данные об окислении ниобия, растворенного в железе, показывают, что этот элемент практически полностью переходит из металла в окислительный шлак. Установленная количественная зависимость показателя распределения ниобия от температуры относится к случаю, когда активность закиси железа в шлаке равна единице. Это позволяет подойти к расчету равновесия реакции окисления ниобия в случае реальных шлаков и оценить возможные потери ниобия при введении его лигатуры. [43]
Описывая известную уже реакцию ниобиевой кислоты с цинком и постепенное изменение окраски от синей до коричневой и затем белой ( на воздухе), Герман замечает: Эти явления, очевидно, указывают на существование низших степеней окисления ниобия: коричневой закиси и синей промежуточной ступени между закисью и кислотой [ 40, стр. Он установил также, что плавы, полученные цри сплавлении ниобиевой кислоты с KHS04 и NaHSO - t, ведут себя различно при выщелачивании водой; первый разлагается с выделением ниобиевой кислоты, как обычно, а второй полностью растворяется в малом количестве кипящей воды. Поэтому сплавление с кислым сернокислым натрием представляет средство, чтобы отделить нио-биевую кислоту от танталовой... Этот метод оказался, однако, мало эффективным и в настоящее время не используется. [44]
Для сравнения в работе показано поведение листов толщиной 0 51 я 0 76 мм из молибдена, ниобия и сплава V-ITi - 60Nb соответственно с покрытиями при окислении. На приведенных в работе фотоснимках виден рост продукта окисления ниобия и отслаивание защитного покрытия, тогда как на ванадиевом сплаве частично расплавленная ванадиениобиевая пленка склонна к самозалечиванию. [45]
Страницы: 1 2 3 4