Окисление - плутоний
Cтраница 1
Окисление плутония от валентностей 3 или 4 до валентностей 5 или 6, либо его восстановление от валентностей 6 или 5 до валентностей 4 или 3 происходит очень медленно, по-видимому, вследствие медленного соединения Ри и О в окисленном состоянии, либо медленного разрыва связи Ри - О в восстановленном состоянии. [1]
Окисление плутония до шестивалентного состояния произво -: дят бихроматом калия. [2]
 |
Влияние степени насыщения трибутилфосфата ураном на коэффициент распределения примесей ( водная фаза - - ЗМ НМОз, органическая фаза - 30 % раствор трибутилфосфата. [3] |
Для окисления плутония в сырец вводится бихромат натрия Na2Cr2O7, количество HNO3 меньше, чей необходимое для образования нитрата уранила, что обеспечивает низкий коэффициент распределения для примесей. Промывающей жидкостью в первой колонне служит раствор нитрата алюминия и бихромата натрия. Во вторую колонну вводится восстановитель и образуется Риш, нерастворимый в метилизобутилкетоне, благодаря чему уран и плутоний разделяются. Водный урановый экстракт после концентрации выпариванием еще раз очищается в двух последовательных колоннах. В конечном итоге содержание примесей в уране уменьшается в 105 - 10е раз. [4]
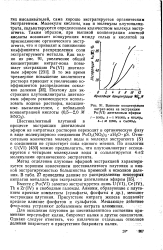 |
Влияние концентрации нитрат-иона на экстракцию Pu ( VI диэтиловым эфиром. [5] |
Для окисления плутония до шестивалентного состояния применяют персульфат калия, бихромат калия и другие окислители. Однако следует отметить, что извлечение отдельных осколков деления возрастает в присутствии бйхромата калия. [6]
На скорость окисления плутония сильное влияние оказывает кислотность раствора и реакции комплексообразования. Нет никакой опасности окисления при нагревании Pulv в концентрированной азотной кислоте, но в горячей разбавленной азотной кислоте оно идет легко. [7]
Для подавления процесса окисления плутония ( Ш) за счет удаления из раствора промежуточного нитрит-иона NOr в катионообменном процессе применяют сульфа. [8]
Неустойчивость высшего состояния окисления плутония по сравнению с нептунием следует из того, что если NpCl4 является высшим бинарным хлоридом нептуния, то высшим хлоридом плутония является PuGlg. Как и ожидалось, тетрахлорид более летуч, чем трихлорид. В соответствии с работой Швецова и Воробьева [18] на различиях в летучести может быть основан метод разделения нептуния и плутония. Если смесь окислов нептуния и плутония хлорировать четереххлористым углеродом при температуре 620 - 650 С, то более 90 % нептуния возгоняется в виде NpGl4 при этом захватывается не более 0 1 % плутония. [9]
Наличие соединений со степенью окисления плутония - f - 4 было доказано путем прокаливания навески нерастворимого иодата, в результате чего получали окись. [10]
Для поддержания нужной степени окисления плутония необходимо создавать соответствующие условия стабилизации. [11]
Шестивалентный плутоний образуется также окислением плутония низших валентных состояний 11 6 М хлорной кислотой при 195; при 100 заметного окисления не наблюдается. В концентрированной азотной кислоте за 15 мин. В концентрированных карбонатных растворах плутоний окисляется до шестивалентного 0 1 М раствором перхлората аммония ( при 95 - 100), персульфатом аммония ( при концентрации его 20 г / л и температуре 75 - 80), озоном ( при 90 - 100); при этом через 10 - 20 мин. [12]
Это объясняется диспропорционированием средних: состояний окисления плутония, которое не доходит до конца вследствие близости окислительно-восстановительных потенциалов различных ионных пар плутония. [13]
 |
Функция образования в системе цирконий - оксалат. [14] |
Следовательно, выводы об устойчивости к окислению плутония ( III), полученные спек-трофотометрическим путем для концентраций 10 - 4 М, не всегда можно распространить на область микроконцентраций плутония. [15]
Страницы: 1 2 3 4