Окисление - алкилароматические углеводород
Cтраница 1
Окисление алкилароматических углеводородов воздухом или кислородом в присутствии солей металлов переменной валентности ( чаще кобальта, реже марганца) имеет ряд особенностей по сравнению с действием азотной кислоты и других сильных окислителей и несколько отличается от окисления углеводородов других классов. [1]
Окисление алкилароматических углеводородов в гидроперекиси проводят обычно в жидкой фазе при 95 - 120 С. Температура может быть и более низкой, но при этом скорость окисления будет меньше. Выше 125 С температуру поднимать не следует, так как при этом происходит распад гидроперекисей и ускоряются побочные реакции окисления, что уменьшает выход продукта. Работа при повышенном давлении уменьшает унос из реактора и увеличивает скорость реакции за счет увеличения концентрации кислорода в жидкой фазе. [2]
Окисление алкилароматических углеводородов воздухом или кислородом в присутствии металлов переменной валентности ( резинаты или нафтенаты кобальта или марганца) протекает через стадию образования гидроперекисей. [3]
Окисление алкилароматических углеводородов воздухом или кислородом в присутствии металлов переменной валентности ( резинаты или нафтенаты кобальта или марганца) протекает через стадию образования гидропероксидов. [4]
Окисление алкилароматических углеводородов воздухом или кислородом в присутствии солей металлов переменной валентности ( чаще кобальта, реже марганца) имеет ряд особенностей по сравнению с действием азотной кислоты и других сильных окислителей и несколько отличается от окисления углеводородов других классов. [5]
Окисление алкилароматических углеводородов воздухом имеет ряд особенностей. [6]
Окислением алкилароматических углеводородов получают альдегиды, кетоны, кислоты и другие кислородсодержащие соединения. [7]
Метод окисления алкилароматических углеводородов с промежуточным получением гидроперекисей достаточно перспективен для синтеза еще одной группы ценных веществ-стирола и его гомологов. [8]
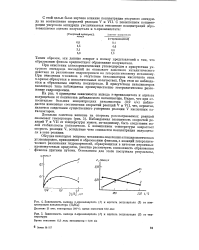 |
Зависимость выхода ге-крезилацетата ( 1 и ацетата полуацеталя ( 2 от температуры Время окисления 12 5 мин. катализатор - 0 36 г / л. [9] |
При окислении алкилароматических углеводородов в присутствии уксусного ангидрида последний не оказывает заметного каталитического действия на разложение гидроперекиси по гетеролитическому механизму. При окислении w - ксилола в отсутствие катализаторов кислотного типа и-крезол образуется в незначительных количествах. При этом не наблюдается и образования ацетата полуацеталя. В присутствии катализаторов кислотного типа наблюдается преимущественно гетеролитическое разложение гидроперекиси. [10]
При окислении алкилароматических углеводородов побочно образуются кислоты, которые могут катализировать распад гидроперекиси. Для предотвращения этого явления в реакционной среде поддерживают определенную кислотность ( обычно 3 рН 10) путем непрерывного добавления в НС1 водного раствора NaOH, карбоната или бикарбоната натрия. [11]
При окислении алифатических и алкилароматических углеводородов карбоновые кислоты образуются с деструкцией цепи. В результате из алканов получаются в основном монокарбоновые кислоты с более короткой цепью, а из нафтеновых - дикарбоновые кислоты. [12]
ООсуждение механизма реакции окисления алкилароматических углеводородов, а основном, ограничивалось преимущественно рассмотрением процесса до стадии ооразования одной карбоксильной группы [70], так как окисление второй метальной группы, связанной с ароматическим ядром, сопряжено с большими трудностями вследствие влияния электронно-акцепторной карбоксильной группы. [13]
 |
Связь между константой & а и функцией Гаммета. [14] |
Как и при окислении алкилароматических углеводородов, заместители, приводящие к увеличению электронной плотности в кольце, ускоряют реакцию, заместители же, понижающие электронную плотность в кольце замедляют реакцию. Диапазон изменений константы скорости реакции R02 RH в зависимости от заместителя невелик - он составляет всего один порядок. [15]
Страницы: 1 2 3 4