Окисление - хлорид-ион
Cтраница 3
Реакция образования свободного хлора является источником ошибок при перманганатометрическом определении восстановителей, приводящих к образованию заметных количеств марганца ( III), но не образующих с ним комплексов. Вещества, способные образовывать комплексы с марганцем ( Ш) - фосфаты, сульфаты, бораты и др., - понижают потенциал системы Мп / Мп2 и предотвращают окисление хлорид-иона. [31]
Характер вольт-амперных кривых серосодержащих соединений зависит не только от природы последних, но и от состава фона. Такое различие в ходе полярографических кривых тиомочевины и унитиола на фоне серной и соляной кислот связано с тем, что при поляризации платины в растворе НС1 при потенциале около 1 3 в начинается окисление хлорид-ионов до элементарного хлора, который препятствует образованию поверхностных окислов платины, а следовательно, и их влиянию на процесс анодного окисления тиомочевины и унитиола. [32]
Характер вольт-амперных кривых серосодержащих соединений зависит не только от природы последних, но и от состава фона. Такое различие в ходе полярографических кривых тиомочевины и унитиола на фоне серной и соляной кислот связано с тем, что при поляризации платины в растворе НС1 при потенциале около 1 3 в начинается окисление хлорид-ионов до элементарного хлора, который препятствует образованию поверхностных окислов платины, а следовательно, и их влиянию на процесс анодного окисления тиомочевины и унитиола. [33]
Скорость и направление протекающей реакции сильно зависят от ( присутствия некоторых посторонних ( веществ, вызывающих параллельные реакции. Реакции, протекающие параллельно, из которых одна оказывает влияние да скорость другой, называют сопряженными или индуцированными реакциями. Так, реакция окисления хлорид-ионов пер-м-анганатом калия протекает очень медленно. Скорость реакции окисления хлорид-ионов в ( присутствии ионов железа значительно увеличивается. Это явление объясняется тем, что реакция окисления железа лермаягаиатом индуцирует реакцию окисления хлорид-ионов. [34]
Стандартный потенциал бихромата калия ниже, чем у перманганата, но все же достаточно высок. Это позволяет титровать почти все те вещества, которые определяют методом перманганатометрии. Однако преимуществом К2Сг2О7 является то, что при титровании в растворе НС1 не наблюдается окисления хлорид-ионов до свободного хлора, как в перманганатометрии. Другое преимущество состоит в устойчивости растворов бихромата - концентрация рабочего раствора при длительном хранении в закрытых сосудах остается практически неизменной. Бихромат калия легко очистить перекристаллизацией; полученный препарат высушивают при 130 - 150 С. [35]
Разность стандартных потенциалов ионов, участвующих в реакции, называется электродвижущей силой ( ЭДС) реакции. Чем больше ЭДС, тем энергичнее протекает реакция. Для реакции окисления сульфит-иона ЭДС равна 1 51 - 0 171 34 В, а для окисления хлорид-иона 1 51 - 1 3590 151 В. Следовательно, более энергично будет протекать реакция окисления сульфит-иона и только после его полного окисления начнет окисляться хлорид-ион. [36]
Поэтому титрование проводят в присутствии защитной смеси Рейнгарда-Циммермана. Эта смесь состоит из серной и фосфорной кислот и сульфата марганца. Фосфорная кислота и сульфат марганца, обеспечивающие понижение потенциала системы Мп ( Ш) / Мп ( П), предотвращают окисление хлорид-иона; фосфорная кислота необходима также для связывания в бесцветный фосфатный комплекс образующегося железа ( III), раствор которого имеет желтую окраску. Серная кислота обеспечивает необходимую кислотность раствора. [37]
Скорость и направление протекающей реакции сильно зависят от ( присутствия некоторых посторонних ( веществ, вызывающих параллельные реакции. Реакции, протекающие параллельно, из которых одна оказывает влияние да скорость другой, называют сопряженными или индуцированными реакциями. Так, реакция окисления хлорид-ионов пер-м-анганатом калия протекает очень медленно. Скорость реакции окисления хлорид-ионов в ( присутствии ионов железа значительно увеличивается. Это явление объясняется тем, что реакция окисления железа лермаягаиатом индуцирует реакцию окисления хлорид-ионов. [38]
В пробирках проводят соответствующие реакции. С разбавленной НС1 реакция не идет, что связано, по-видимому, с кинетическими затруднениями процессов разрушения иона МпО4 - и образованием молекулы хлора из атомов. В) должно идти окисление хлорид-иона перманганат-ионом. [39]
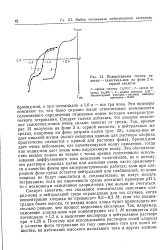 |
Подпрограммы систем галоген - галогенид-ион на фоне 2 н. серной кислоты. [40] |
Эти примеры поясняют то, что было сказано выше относительно возможности селективного определения отдельных ионов методом амперометри-ческого титрования. Следует только добавить, что анодное окисление галогенид-ионов очень сильно зависит от среды. Это обстоятельство весьма важно не только с точки зрения селективного использования диффузионного тока окисления галогенидов, но и потому, что растворы хлорида калия или аммония очень часто применяются в качестве фонов при амперометрических работах; если при хло-ридном фоне среда остается нейтральной или слабокислой, то ионы хлорида не будут окисляться и, следовательно, не могут мешать титрованию; если же кислотность среды достигнет примерно рН 1, то с возможным окислением хлорид-иона уже нельзя не считаться. Следует заметить, что сказанное относительно окисления хлорид-иона в нейтральной среде справедливо для тех случаев, когда концентрация хлорида не превышает 0 2 - 0 3 М; если его концентрация более высока, то разряд ионов хлора будет происходить несколько раньше, чем процесс выделения кислорода. [41]
 |
Подпрограммы систем галоген - галогенид-ион на фоне 2 н. серной кислоты. [42] |
Эти примеры поясняют то, что было сказано выше относительно возможности селективного определения отдельных ионов методом амперометри-ческого титрования. Следует только добавить, что анодное окисление галогенид-ионов очень сильно зависит от среды. Это обстоятельство весьма важно не только с точки зрения селективного использования диффузионного тока окисления галогенидов, но и потому, что растворы хлорида калия или аммония очень часто применяются в качестве фонов при амперометрических работах; если при хло-ридном фоне среда остается нейтральной или слабокислой, то ионы хлорида не будут окисляться и, следовательно, не могут мешать титрованию; если же кислотность среды достигнет примерно рН 1, то с возможным окислением хлорид-иона уже нельзя не считаться. Следует заметить, что сказанное относительно окисления хлорид-иона в нейтральной среде справедливо для тех случаев, когда концентрация хлорида не превышает 0 2 - 0 3 М если его концентрация более высока, то разряд ионов хлора будет происходить несколько раньше, чем процесс выделения кислорода. [43]
В живых организмах происходит восстановление кислорода. Кроме того, лейкоциты используют Н2О2 для окисления хлорид-ионов в хлорноватистую кислоту НОС1, которая также служит средством для уничтожения бактерий. Подобные защитные механизмы действуют не только у млекопитающих, но и у растений, насекомых и простейших организмов. К сожалению, реакционноспособные соединения кислорода и хлора не только убивают проникающие микроорганизмы, но могут наносить ущерб и тканям организма-хозяина, повреждая важные биомолекулы, такие, как липиды, белки и ДНК. [44]
Скорость и направление протекающей реакции сильно зависят от ( присутствия некоторых посторонних ( веществ, вызывающих параллельные реакции. Реакции, протекающие параллельно, из которых одна оказывает влияние да скорость другой, называют сопряженными или индуцированными реакциями. Так, реакция окисления хлорид-ионов пер-м-анганатом калия протекает очень медленно. Скорость реакции окисления хлорид-ионов в ( присутствии ионов железа значительно увеличивается. Это явление объясняется тем, что реакция окисления железа лермаягаиатом индуцирует реакцию окисления хлорид-ионов. [45]
Страницы: 1 2 3