Окись - стирол
Cтраница 1
Окись стирола, фенилглицидиловый и аллилглицидиловый эфиры применяют в качестве реакционноспособных разбавителей для эпоксидных смол. Аллилглицидиловый эфир используют как сомономер с окисью пропилена для получения каучуков с боковыми двойными связями, позволяющими осуществлять вулканизацию серой. [1]
Окись стирола интересна тем, что здесь имеется возможность путем введения заместителей в кольцо сильно влиять на характер эффекта кольца. Автор предполагает заняться изучением реакций таких замещенных окисей. [2]
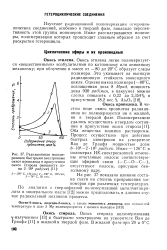 |
Радиационная полимеризация быстрыми электронами окиси пропилена в присутствии окиси стирола ( мощность дозы 2 - 105 рад / сек [ И ]. [3] |
Окись стирола полимеризована у-излучением [13] и быстрыми электронами на ускорителе Ван де Граафа [11] в жидкой и твердой фазе. [4]
Окись стирола полимеризуется под влиянием описанных выше катализаторов, образуя лишь низкомолекулярные продукты. Поскольку на 1 моль катализатора образуется большое число молей полимера, то очевидно, что в этом случае передача на мономер играет большую роль. [5]
Окись стирола синтезируют из стирола хлоргидринным спосо -, бом ( стр. [6]
Окись стирола, фенилглицидиловый и аллилглицидиловый эфиры применяют в качестве реакционноспособных разбавителей для эпоксидных смол. Аллилглицидиловый эфир используют как сомономер с окисью пропилена для получения каучуков с боковыми двойными связями, позволяющими осуществлять вулканизацию серой. [7]
Если окись стирола перегонять, нагревая колбу голым пламенем, то происходит небольшое разложение, заметное по образованию воды. При нагревании колбы на масляной бане перегонка идет без разложения. [8]
Однако окись стирола является второстепенным продуктом реакции. [9]
Производство окиси стирола в последние годы существенно возросло, а цена, составлявшая еще в 1953 г. 1 доллар за фунт, в 1955 г. составляла 60 центов. [10]
Так, окись стирола С6Н5 СН - СН2, по Фурно и Тиффено. [11]
Так, окись стирола превращается почти исключите. [12]
С водой окись стирола реагирует лишь при 150 - 200 и рН - 12, образуя 1-фенилэтандиол - 1, 2 С6Н5СН ( ОН) СН. [13]
Получается гидролизом окиси стирола. [14]
Окисление стирола в окись стирола кислородом воздуха в присутствии серебряного катализатора37 протекает аналогично окислению этилена. Реакция проводится при 250 - 300 С. [15]
Страницы: 1 2 3 4