Полуторная окись
Cтраница 2
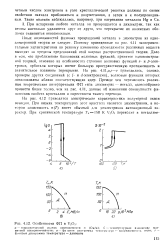 |
Особенности ФП в V2O3. [16] |
На рис. 4.12 приводятся электрические характеристики полуторной окиси ванадия. При низких температурах этот кристалл является диэлектриком, в котором зависимость о ( Т) имеет обычный для диэлектриков а. [17]
Технически оксид хрома СпОз, или полуторную окись хрома, получают путем восстановления бихромата натрия с помощью либо древесного угля, либо серы. Восстановление серой практикуется обычно в тех случаях, когда оксид хрома предназначается для изготовления красителя. Для металлургических процессов, как правило, применяют восстановление углем. [18]
Некоторые чистые окислы, например окись хрома и полуторная окись молибдена ( Моа03), при температуре 450 - 500 дают частичную циклизацию. Пой более высокой температуре эти окислы теряют свою активность и практически не пригодны для ароматизации. Применяя соответствующие носители, из этих окислов можно приготовить активные катализаторы, работающие свыше тысячи часов. [19]
При восстановлении закиси железа и двуокиси титана до полуторной окиси ( с применением углеродистых веществ) в результате плавки может быть получен электрокорунд титанистый. [20]
При очень сильном нагревании двуокись празеодима переходит в полуторную окись. [21]
Америций является первым актинидным элементом, который в своей полуторной окиси обнаруживает поведение, характерное для редких земель. [22]
Оказывается, что изменения магнитной восприимчивости с увеличением содержания полуторной окиси хрома обусловлены главным образом изменениями константы Вейсса, в то время как изменения константы Кюри сравнительно малы. Константа Кюри количественно характеризует степень окисления исследуемого соединения, в то время как константа Вейсса в данном конкретном случае скорее всего количественно оценивает воздействие электронов ближайших парамагнитных компонентов. Вычисления показывают, что число ближайших смежных групп Сг - Сг быстро возрастает с увеличением концентрации окиси хрома до образования трех последовательных слоев окиси хрома; после достижения этого состояния число ближайших смежных групп атомов возрастает со значительно меньшей скоростью. [23]
При дальнейшем охлаждении расплава происходит почти одновременная кристаллизация шпинели и полуторной окиси титана. [24]
В случае высших окислов II, III и IV основных подгрупп и полуторных окисей элементов V основной подгруппы наблюдаются увеличения показателей преломления и средних дисперсий окислов при переходе от легких элементов к более тяжелым. [25]
Пра высушивании этого соединения в вакууме оно разлагается, и в безводном состоянии полуторная окись платины Pt2O3 получена не была. [26]
Сера образует четыре окисла: трехокись серы S0a, двуокись серы 502, полуторную окись 5203 и моноокись серы SO; из них наибольшее значение имеют первые два. [27]
Если путем выпаривания раствора хлористого ир дия с углекислым калием и прокаливания остатка выделили полуторную окись иридия, ее легко можно перевести в металл прокаливанием в токе водорода. Хлористые соединения иридия при прокаливании в токе водорода тоже дают металлический иридий. [28]
Из уравнения 2ТЮ2 С - - Ti2O3 CO следует, что для восстановления двуокиси титана до полуторной окиси требуется 8 5 вес. Но с учетом вносимого электродами углерода следует добавлять около 2 3 % антрацита от веса добавленной к плавке двуокиси титана. [29]
При нагревании это соединение разлагается, выделяя кислород и платину вместе с твердым раствором закиси или полуторной окиси с окисью. Окись платины представляет собой черный порошок, нерастворимый в кислотах. [30]
Страницы: 1 2 3 4