Координационное окружение
Cтраница 1
Координационное окружение вокруг одного из ионов Са дополнено до целого куба. [1]
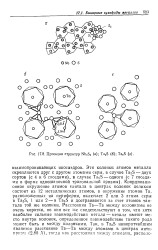 |
Проекции структур Nb3S4 ( a. Ta2S ( б. Ta6S ( в. [2] |
Координационное окружение атомов тантала в центрах колонок целиком состоит из 12 металлических атомов, а окружение атомов Та, расположенных на периферии, включает 2 или 3 атома серы в Ta2S, 1 или 2 - в TaeS и достраивается за счет атомов тантала той же колонки. Расстояния Та-Та между колонками не очень коротки, но они все же свидетельствуют о том, что хотя наиболее сильные взаимодействия металл - металл имеют место внутри колонок, определенное взаимодействие такого рода может быть и между колонками. [3]
В координационном окружении атома М могут одновременно присутствовать NH3 и X, как это имеет место в структурах [ Co ( NH3) 5Cl ] Cl2 и [ Pt ( NH3) 3Cl3 ] Cl. Некоторые из этих вер-неровских координационных соединений подробнее рассмотрены в гл. [4]
Большинство сведений о координационном окружении атомов ( например, наличие трехгранной бипирамиды у пятивалентного фосфора) получено при помощи рентгеноструктурного анализа. [5]
Кроме того, в координационное окружение атома Sn входят три атома С1 анионов А1СЦ - на больших расстоя-янйях ( 2 84 - 3 33 А) и симметрично связанная ароматическая молекула. [6]
Установление строгой корреляции между координационным окружением, d - электронной конфигурацией металла и пептидазной активностью в настоящее время затруднено из-за неопределенности в стереохимии координации Ni ( II) - замещенного фермента. [7]
Не происходит также количественного изменения координационного окружения атома углерода. [8]
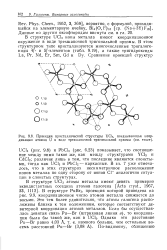 |
Проекция кристаллической структуры UCla, показывающая координацию атомов U в виде трехшапочной тригональной призмы ( текст. [9] |
В структуре UC13 ионы металла имеют координационное окружение в виде трехшапочной тригональной призмы. [10]
На рис. 3 - 10 показано ближайшее координационное окружение кобальта в двух независимых молекулах этого комплекса, содержащего молекулярный азот. [11]
Здесь каждый атом железа находится в тетраэдрическом координационном окружении. [12]
 |
Методы получения аморфных тел. [13] |
Только те аморфные тела, у которых координационные окружения в жидкости в твердом теле близки, могут быть приготовлены путем охлаждения из расплава. Они обычно называются стеклами. Многие составы стекол очень стабильны и могут быть нагреты до расплавленного состояния без кристаллизации. [14]
Поэтому электроны на этих орбиталях подвергаются сильному влиянию координационного окружения; в свою очередь сами d - электроны существенно влияют на соседние атомы или ионы. Многие свойства ионов с частично заполненной d - оболочкой очень чувствительны к числу и распределению d - электронов. В противоположность этому 4 / - орби-тали у лантанидов расположены довольно глубоко внутри электронной оболочки атома или иона. Находящиеся на них электроны заметно экранируются менее глубоко лежащими оболочками ( 5s, 5р), в результате чего взаимодействие между 4 / - электронами и соседними атомами или ионами мало отражается на химических свойствах центрального атома. Вот почему все лантаниды подобны друг другу в химическом отношении, тогда как изменения химических свойств элементов d - труппы носят совершенно нерегулярный характер. В этом смысле актиниды занимают промежуточное положение между обоими типами групп, так как 5 / - орбитали пространственно расположены не столь глубоко, как 4 / -, но и не настолько вытянуты по периферии атома, как d - орбитали. [15]
Страницы: 1 2 3 4 5