Простой оксид
Cтраница 1
Простые оксиды и халькогениды, хотя и относятся к ионным соединениям, характеризуются значительной овалентностью химических связей. [1]
Свойства простых оксидов определяются характером связанного с кислородом элемента. Оксиды химически активных металлов характеризуются основными свойствами. [2]
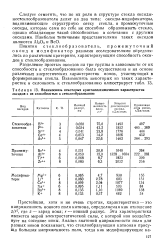 |
Взаимосвязь некоторых кристаллохимических характеристик оксидов с их способностью к стеклообразованию. [3] |
Разделение простых оксидов на три группы в зависимости от их способности к стеклообразованию была осуществлена и на основе различных энергетических характеристик ионов, участвующих в формировании стекла. [4]
Свойства простых оксидов определяются характером связанного с кислородом элемента. Оксиды химически активных металлов характеризуются основными свойствами. По мере уменьшения активности металлов, а особенно при переходе к неметаллическим элементам свойства их оксидов непрерывно изменяются от типично основных через амфотерные к кислотным. [5]
Свойства простых оксидов определяются характером металла. Оксиды наиболее активных металлов характеризуются основными свойствами. По мере уменьшения активности металлов свойства их оксидов непрерывно изменяются от типично основных через амфотерные к кислотным. [6]
У большинства простых оксидов атомы металлов находятся в одной степени окисления, и все атомы металла имеют либо одинаковое, либо приблизительно одинаковое окружение. [7]
Эти правила позволили дифференцировать все простые оксиды на три группы: 1) нестеклообразующие; 2) стеклообразующие; 3) промежуточные. К первой группе относятся оксиды состава R2O и RO, не удовлетворяющие критериям Захариассена. Ко второй группе относятся оксиды состава R02 и R2O5, в полной мере отвечающие рассмотренным критериям. Для оксидов типа R2O3 стекло-образование имеет место, если атомы кислорода формируют вокруг атома металла треугольники. [8]
Химический анализ показывает содержание именно простых оксидов, а не сложных соединений - компонентов тройной диаграммы. [9]
Fe, Co и Ni образуют как простые оксиды типа ЭО и Э2Оз, так и смешанные - ЭзС 4, причем Ni2Os и Со2Оз малоустойчивы. [10]
Fe, Co и Ni образуют как простые оксиды типа ЭО и Э2Оз, так и смешанные - ЭзС 4, причем Ni2Os и Со2Оз малоустойчивы. [11]
Fe, Co и Ni образуют как простые оксиды типа ЭО и Э2Оз, так и смешанные - ЭзО4, причем NigOa и Со2Оз малоустойчивы. [12]
Захариасеи ( 1932 г.) изучил относительную склонность простых оксидов к стеклообразованию н сделал вывод о том, что важнейшим условием стеклообразьванин является способность вещества образовывать непрерывную трехмерную сетчатую структуру, в которой отсутствует дальний порядок. На основании такого подхода Захариассп сформулировал ряд правил, которые щрают большую роль при излишни стеклообразного состояния твердых тел. Поскольку строение стекол обычно неизвестно, эти правила оперируют с кристаллическими структурами соответствующих оксидов, из которых образуются или не образуются стекла. При обсуждении этих правил необходимо различать кислородные атомы и другие атомы в бинарных оксидах. [13]
В ранних работах неоднократно делались попытки использовать для активации угольных электродов простые оксиды. Однако на основании современных данных более перспективными с точки зрения и электрокаталитической активности и стабильности являются сложные оксиды. Исключение составляет, возможно, оксид марганца, который обладает способностью к частичной регенерации кислородом воздуха после восстановления. Поэтому предлагается [100] введение МпО2 в угольные воздушные электроды для повышения их емкости в короткие периоды перегрузок. [14]
 |
Диаграмма состояния системы СаО - AI2O3 - SiOz. [15] |
Страницы: 1 2 3 4