Оксирадикал
Cтраница 2
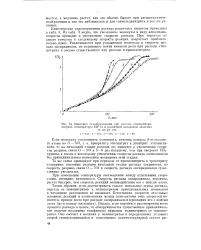 |
Кинетика газообразования при распаде глицсринтри-нитрита ( температура 150 С и различном начальном давлении. [16] |
То же самое произойдет при переходе от пропилнитрита к тринитриту глицерина: основные реакции начальной стадии распада сохранятся, но скорость разрыва связи О - N0 и скорость распада оксирадикалов существенно увеличатся. [17]
Для динитритов [50] при сравнительно высоких температурах ( - 300 С) первой ступенью распада также является образование NO и оксирадикала. Дальнейшая судьба оксирадикала ( распад или перегруппировка с отщеплением N02) зависит от его структуры. [18]
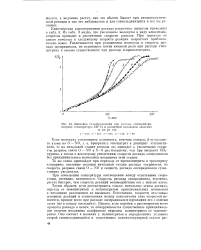 |
Кинетика газообразования при распаде глицсринтри-нитрита ( температура 150 С и различном начальном давлении. [19] |
При повышении температуры соотношения между отдельными скоростями, очевидно, изменяются. Скорость распада оксирадикала, вероятно, растет быстрее, чем скорость реакций взаимодействия его с окисью азота. [20]
Наиболее активные в реакциях сшивания сорта сажи содержат высококонцентрированные ароматические углеводороды. Так как часть оксирадикалов, образующихся при распаде пероксида, расходуется на взаимодействие с сажей, в саженаполненные композиции для достижения равных эффектов следует вводить больше сшивающего агента, чем в ненаполненные. На процесс пероксид-ного сшивания влияют также площадь поверхности частиц сажи и ее кислотность. [21]
При этом изменения геометрии и электронного строения пероксида приближают его к конфигурации переходного состояния. Распад комплекса происходит с образованием оксирадикалов и регенерацией аммониевой соли. Таким образом, исследование реакции распада пероксидов циклогексанона в присутствии бромида тетраэтиламмония в ацетонитриле показало, что бромид тетраэтиламмония в данной системе проявляет каталитические свойства, увеличивая скорость реакции распада пероксидного субстрата по сравнению с термолизом. Полученные кинетические данные свидетельствуют о том, что реакция распада пероксида циклогексанона в присутствии бромида тетраэтиламмония протекает через стадию образования комплекса между реактантами. Комплексно связанный пероксид циклогексанона распадается с образованием свободных радикалов. Базируясь на результатах квантово-химического моделирования ассоциации оксипероксидных соединений циклогексанона с Et4N Br -, показано, что вероятным является образование комплекса между реактантами в виде суб-страторазделенной ионной пары, а катализ их распада происходит по супрамолекулярному механизму. [22]
При этом изменения геометрии и электронного строения пероксида приближают его к конфигурации переходного состояния. Распад комплекса происходит с образованием оксирадикалов и регенерацией аммониевой соли. Таким образом, исследование реакции распада пероксидов циклогексанона в присутствии бромида тетраэтиламмония в ацетонитриле показало, что бромид тетраэтиламмония в данной системе проявляет каталитические свойства, увеличивая скорость реакции распада пероксидного субстрата по сравнению с термолизом. Полученные кинетические данные свидетельствуют о том, что реакция распада пероксида циклогексанона в присутствии бромида тетраэтиламмония протекает через стадию образования комплекса между реактантами. Комплексно связанный пероксид циклогексанона распадается с образованием свободных радикалов. Базируясь на результатах квантово-химического моделирования ассоциации оксипероксидных соединений циклогексанона с Et4N - Br -, показано, что вероятным является образование комплекса между реактантами в виде суб-страторазделенной ионной пары, а катализ их распада происходит по супрамолекулярному механизму. [23]
При этом изменения геометрии и электронного строения пероксида приближают его к конфигурации переходного состояния. Распад комплекса происходит с образованием оксирадикалов и регенерацией аммониевой соли. Таким образом, исследование реакции распада пероксидов циклогексанона в присутствии бромида тетраэтиламмония в ацетонитриле показало, что бромид тетраэтиламмония в данной системе проявляет каталитические свойства, увеличивая скорость реакции распада пероксидного субстрата по сравнению с термолизом. Полученные кинетические данные свидетельствуют о том, что реакция распада пероксида циклогексанона в присутствии бромида тетраэтиламмония протекает через стадию образования комплекса между реактантами. Комплексно связанный пероксид циклогексанона распадается с образованием свободных радикалов. Базируясь на результатах квантово-химического моделирования ассоциации оксипероксидных соединений циклогексанона с Et4N Br -, показано, что вероятным является образование комплекса между реактантами в виде суб-страторазделенной ионной пары, а катализ их распада происходит по супрамолекулярному механизму. [24]
Оксирадикалы также могут взаимодействовать как путем рекомбинации, так и путем диспропорционирования. Результаты изучения механизма и кинетических особенностей взаимодействия оксирадикалов подробно проанализированы в монографии Эмануэля, Денисова и Майзус [ 18, с. Для метокси - и этоксира-дикалов дйспропорционирование преобладает над рекомбинацией. [25]
Оптимум свойств сшитых продуктов наблюдается при введении около 35 вес. Повышенная восприимчивость сажи сшивающимися полиолефиновыми композициями объясняется способностью сажи реагировать с возникающими при распаде перекисей оксирадикалами с образованием собственных радикалов. [26]
В результате указанных реакций эффективность компонентов смеси увеличится, что должно проявиться в синергическом эффекте. Однако этот общий механизм действия смесей фенолов или аминов с эфирами фосфористой кислоты, по-видимому, будет зависеть от строения оксирадикалов эфиров фосфористой кислоты. [28]
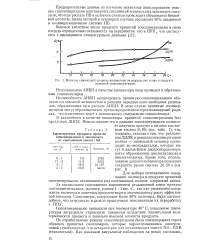 |
Влияние химической природы инициатора на содержание хлора в продукте привитой сополимеризации. [29] |
В дальнейшем в качестве инициатора привитой сополимеризации был предложен ДЦПК. Использование его в реакции сополимеризации позволяет получить продукт с низким кислотным числом ( 0 16) ( см. табл. 1), что, очевидно, связано с тем, что разложение ДЦПК в реакции сополимеризации полиол - винильный мономер происходит до оксирадикалов, которые могут в дальнейшем диспропорциониро-ватьс образованием циклогексанола и циклогексанона. [30]
Страницы: 1 2 3