Ароматическое оксисоединение
Cтраница 2
Пригодность ароматических оксисоединений в качестве пластификаторов триацетата целлюлозы была впервые установлена Битти 9Б в 1912 г. на примере диоксидифенилметана. Фирма Insulated Cables 96 установила, что из смеси 35 % диоксидифенилметана, 40 % бензилового спирта и триацетата целлюлозы при 190 С образуется однородная пластическая масса. Аналогичным образом ведет процесс фирма Farbwerke Hoechst 97, которая предлагает применять этилиденфенол. Ту же мысль высказывает Берингер 98, предлагающий в качестве пластификаторов монооксиди-фенилен и оксидифенилметан, а также гомологи этих соединений с большим числом ОИ-групп в бензольном ядре. [16]
Хиноны, ароматические оксисоединения и амины переходят при этом в дигидросульфо-кислоты. [17]
Хиноны и ароматические оксисоединения в кето-форме реагируют с солями сернистой кислоты, образуя бисульфитные производные, изолируемые или непосредственно участвующие в дальнейших химических превращениях. [18]
Из класса ароматических оксисоединений широко опробованы119 алкилфено-лы в количестве 2 % для дивинил-стирольного и дивинил-нитрил-акрилового каучуков. Авторы этой работы119 пришли к выводу, что мо-ноалкилфенолы обладают наименьшей активностью. [19]
Из класса ароматических оксисоединений широко опробованы119 алкилфено-лы в количестве 2 % для дивинил-стирол ьного и дивинил-нитрил-акрилового каучуков. [20]
Щелочную конденсацию ароматических оксисоединений с альдегидами проводят в безводной среде при температурах до 130 С, часто в растворе в алифатическом спирте. Конденсация насыщенных кетонов, например ацетона, циклогексанона и ацетофенона, с фенолом или 2 4 -, или 2 6-дизамещенными фенолами, при 100 - 200 С в присутствии фенолятов щелочных или щелочноземельных металлов в качестве катализаторов, приводит к образованию производных ди - ( оксифенил) - метана с высокими выходами. И в этом случае избыток ароматического оксисоединения ( 3 - 7 моль на 1 моль кетона) способствует образованию бис-фенола. Количество применяемых фенолятов щелочных или щелочноземельных металлов должно быть не меньше, чем 1 моль и не больше, чем 2 5 моль на 1 моль кетона. [21]
При использовании ароматических оксисоединений [1433- 1452] получаются эпоксисмолы, обладающие рядом ценных качеств. [22]
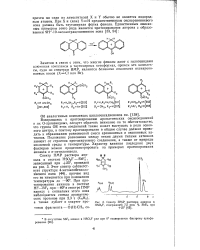 |
Спектр ПМР раствора анизола в. [23] |
Возвращаясь к протонированию ароматических оксисоединений и их О-производных, следует обратить внимание на то обстоятельство, что группа OR этих соединений также может выступать в роли основного центра, и поэтому тротонирование в общем случае должно приводить к образованию равновесной смеси аренониевых и оксониевых катионов. Положение равновесия между этими двумя типами катионов зависит от строения протанируемого соединения, а также от природы кислотной среды и температуры. [24]
В результате реакции незамещенных ароматических оксисоединений с формальдегидом в присутствии щелочи образуется смесь моно - и полиоксиметилзамещенных ароматических оксисоединений, из которой невозможно или очень трудно выделить индивидуальные вещества. В процессе получения резола в числе промежуточных продуктов образуются и производные ди - ( окси-фенил) - метана. [25]
Циклогександиолы получаются гидрированием соответствующих ароматических оксисоединений - фенолов. [26]
Формальдегид, сульфит и ароматические оксисоединения легко образуют ш-суль-фометидпроизводиые, подобно тому как бисульфитиое соединение формальдегида может служить для введения ш-сульфометильиого остатка в аминогруппу ( см. гл. [27]
Араминированию чаще всего подвергают ароматические оксисоединения, реже - галоидопроизводные. В качестве араминирующих агентов применяют n - толуидин и реже анилин. [28]
Араминированию чаще всего подвергают ароматические оксисоединения, реже - галоидопроизводные. В качестве араминирующих агентов применяют я-толуидин и реже анилин. [29]
Эфирные масла растений содержат преимущественно ароматические оксисоединения, альдегиды и кетоны, а также кислоты и их эфиры. Все эти соединения обладают специфическими запахами эфирных масел. [30]
Страницы: 1 2 3 4