Определение - аминокислотный состав
Cтраница 2
Изучение химического строения белка начинают с определения аминокислотного состава. Для этого проводят полный кислотный гидролиз белка с последующим разделением и идентификацией аминокислот гидролизата. С развитием методов хроматографии эта задача решается достаточно просто. [16]
Благодаря широкому применению автоматических аминокислотных анализаторов определение аминокислотного состава пептидов не представляет в настоящее время значительных трудностей. Однако один из важнейших вопросов установления первичной структуры белков и пептидов - определение последовательности аминокислотных остатков в цепи продолжает оставаться весьма трудоемким и сложным. Недавно было установлено, что при масс-спектрометрировании эфиров N-ацилированных олигопептидов в качестве первого акта фрагментации молекулярного иона происходит элиминация алк-оксильной группы и возникает линейный ион, у которого положительный заряд локализован на С-конце, а N-конец защищен ацильным остатком. Дальнейший распад этого иона заключается в последовательной элиминации аминокислотных остатков с перемещением положительного заряда вдоль цепи. [17]
В клинической лабораторной практике основным методом определения аминокислотного состава мочи является хроматография на бумаге. [18]
Указанные выше аналитические методы были использованы для определения аминокислотного состава различных белков. [19]
В последние годы достигнуты большие успехи в технике определения аминокислотного состава белка. Сконструированы автоматические аппараты, которые через 12 ч после введения в них гидролизата белка дают ответ о качественном и количественном содержании в данном белке различных аминокислот. [20]
В последние годы достигнуты большие успехи в технике определения аминокислотного состава белка. Сконструированы автоматы, которые через 24 ч после введения в них гидролизата белка дают ответ о качественном и количественном содержании в данном белке различных аминокислот. [21]
В последние годы достигнуты большие успехи в технике определения аминокислотного состава белка. Сконструированы автоматы, которые через 24 часа после введения в них гидролизата белка дают ответ о качественном и количественном содержании в данном белке различных аминокислот. [22]
Определение содержания иона металла ( в металлопротеидах) или определение аминокислотного состава белка позволяет вычислить минимальные молекулярные веса. Такой расчет основан на допущении, что каждая молекула данного белка содержит один и только один атом металла или один и только один аминокислотный остаток данного тина. Если молекула белка содержит более чем один такой компонент, то вычисленный молекулярный вес будет меньше истинного молекулярного веса во столько раз, во сколько число таких компонентов, входящее в молекулу белка, больше единицы. [23]
В настоящее время разработан более точный и быстрый метод определения аминокислотного состава белков с помощью ионообменных смол. [24]
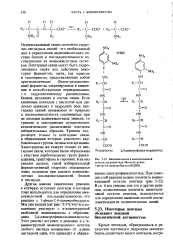 |
Введение метки в аминоконцевой остаток тетрапептида. Меткой служит 1 -фтор - 2 4-динитробензол ( ФДНБ. [25] |
Осуществленный таким способом гидролиз пептидных связей-это необходимый шаг в определении аминокислотного состава белков и последовательности составляющих их аминокислотных остатков. Если кипячение пептидов с кислотой или щелочью приводит к гидролизу всех пептидных связей независимо от природы и последовательности соединенных при их помощи аминокислотных звеньев, то трипсин и химотрипсин осуществляют каталитическое расщепление пептидов избирательным образом. Трипсин гид-ролизует только те пептидные связи, в образовании которых участвуют карбоксильные группы лизина или аргинина. Химотрипсин же атакует только те пептидные связи, которые были образованы с участием карбоксильных групп фенил-аланина, триптофана и тирозина. Как мы увидим дальше, такой избирательный ферментативный гидролиз оказывается очень полезным при анализе аминокислотных последовательностей белков и пептидов. [26]
В книге достаточно детально рассмотрены основные преимущества и недостатки классического метода определения аминокислотного состава белков с помощью ионообменной хроматографии по Муру и Стейну; даны указания относительно выбора ионообменников, подготовки реактивов и численной интерпретации результатов. Значительное место также уделено изложению принципов анализа аминокислот методом газожидкостной хроматографии. Применение этого метода, обладающего на 2 - 3 порядка большей чувствительностью по сравнению с нингидринной реакцией по Муру и Стейну, позволяет значительно снизить количества белка, требуемые для определения его состава. Анализ аминокислот с помощью газожидкостной хроматографии пока еще не находит широкого применения, однако имеющиеся в литературе данные позволяют считать этот метод весьма перспективным. Кроме того, обсуждаются возможности использования газожидкостной хроматографии в сочетании с масс-спектромет-рией для определения состава и аминокислотной последовательности в пептидах. [27]
В отличие от анализа смеси свободных аминокислот или физиологических жидкостей при определении аминокислотного состава ( АН-состава) белка приходится столкнуться с немалыми трудностями, вытекающими из необходимости осуществления его полного гидролиза. Общепринятым методом является исчерпывающий гидролиз 6 и. Без существенных изменений до сих пор используется пропись, предложенная еще Муром и Штейном. [28]
Существуют многочисленные пути синтеза пептидов и полипептидов в лабораторных условиях, методы определения аминокислотного состава и последовательности связи аминокислот в макромолекуле. [29]
Помимо того, что аминокислотный анализ существенно важен для изучения пищевых продуктов, определение аминокислотного состава является основным элементарным исследованием при изучении химии белка. У многих авторов имеется тенденция к переоценке значения аналитических данных; тем не менее точный анализ может дать сведения о степени чистоты, минимальном молекулярном весе и суммарном распределении полярных и неполярных групп в молекуле белка. [30]
Страницы: 1 2 3 4