Пепсин
Cтраница 3
Пепсин действует преимущественно на внутренние пептидные связи, довольно далеко расположенные от концов полипептидной цепи, так как среди продуктов пепти-ческого гидролиза белка находят значительное количество полипептидов. Однако под влиянием пепсина разрываются также и некоторые пептидные связи, находящиеся на конце полипептидной цепи. [31]
Пепсин следует считать ферментом, разрывающим связи избирательно, поскольку не все их типы одинаково доступны его действию. [32]
Пепсин выделяется слизистой оболочкой желудка всех животных. Автор очевидно имеет здесь в виду лишь те виды животных, желудки которых имеют значение для промышленного получения пепсина. [33]
Пепсины, проконтролированные вышеуказанными методами, обозначают кратко 1: 100, 1: 2500, 1: 3000; но при этом надо иметь в виду, что условия различных методов не совпадают, и что, следовательно, между этими обозначениями силы действия не существует соотношения количеств, выраженных в числах. Так, например, пепсин 1: 3000, проконтролированный по методу Американской Фармакопеи, не представляет собой препарат, действующий в 30 раз сильнее, чем пепсин 1: 100 Германской Фармакопеи. Далее, Фармакопеи нормируют только минимальную силу фермента, поэтому ее требованиям отвечает и каждый более высокий по качеству пепсин. Если же речь будет итти об определении действительной ферментативной силы пепсина ( при определенной длительности воздействия), то нужно пользоваться другими методами. [34]
 |
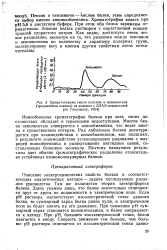
Схема действия трипсиногена и образование активной группы трипсина. [35] |
Пепсин производится организмом в виде пепсиногена; при активации от пепсииогена отрывается очень большой фрагмент. [36]
 |
Хроматограмма смеси пепсина и пепсиногена. [37] |
Пепсин и пепсиноген - кислые белки, этим определяет-ся выбор именно анионообменника. [38]
Пепсин представляет собой порошкообразное или чешуйчатое вещество, имеющее окраску от светложелтой до коричневой; получается экстракцией железистого слоя свежего желудка свиньи. Пепсин содержит протеолитические энзимы, которые в желудке превращают белки в протеозы и пептоны. Далее в кишечнике про-теозы и пептоны расщепляются трипсином и эрепсином в аминокислоты. [39]
Пепсин обладает очень широкой специфичностью. Хотя в опытах с синтетическими субстратами преимущественно расщеплялись связи, образованные аминогруппами ароматических аминокислот, имеется много примеров, когда такие связи в белках устойчивы к действию пепсина. Атаке подвергаются только пептидные связи; амиды и сложные эфиры не расщепляются. [40]
Пепсин - главный протеолитическнй фермент желудочного сока. Кроме пепсина в желудочном соке детей и молодых животных находят протеолитнческий фермент реннин ( химозин, сычужный фермент), обладающий высокой створаживающей активностью. Субстратом реннина является основной белок молока-казеиноген. В результате расщепления реннином казеиноген переходит в казеин. В присутствии ионов Са казеин превращается в творожистую массу, которая затем подвергается расщеплению пепсином. [41]
Пепсин, трипсин в химотрипсин вырабатываются железистыми клетками в виде неактивных преферментов - препепсина, претрипсина и прехимотрипсина ( пепсиноге-на, трипсиногена, химотрипсиногена соответственно старой номенклатуре), так как их активные центры блокированы дополнительными пептидами, после гидролитического отщепления которых фермент приобретает активность. [42]
Пепсин, используемый для гидролиза молока перед экстракцией. [43]
 |
Гипотетическая молекула белка. [44] |
Пепсин гидролизует пептидную связь, в образовании которой участвует аминогруппа ароматической аминокислоты, при условии, что кислота, связанная Х - связью, не содержит свободной аминогруппы. [45]
Страницы: 1 2 3 4