Пепсиноген
Cтраница 3
Пепсин вырабатывается слизистой оболочкой желудка в неактивной форме - пепсиноген. Обе формы пепсина получены в чистом кристаллическом состоянии, причем установлено, что, подобно остальным протеолитическим ферментам, они являются простыми белками. Пепсиноген превращается в пепсин под влиянием еильтгокислой среды желудка. Образующийся пепсин вызывает превращение новых количеств пепсиногена в пепсин. Следовательно, этот процесс является автокаталитическим. [31]
Главные клетки ( называемые также зи-могенными) секретируют неактивные ферменты пепсиноген и прореннин. Неактивные формы ферментов называют зи-могенами. [33]
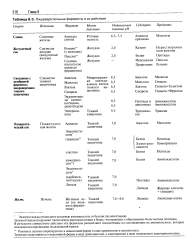 |
Пищеварительные ферменты и их действие. [34] |
Реннин и пепсин секретируются в неактивной форме в виде прореннина и пепсиногена. Трипсин секретируется в неактивной форме в виде трипсиногена, а химотрипсин в виде неактивного химотрипсиногена. [35]
В ходе этого процесса ( рис. 24 - 4) с N-конца полипептидной цепи пепсиногена отщепляются 42 аминокислотных остатка в виде смеси коротких пептидов. Остающаяся интактной остальная часть молекулы пепсиногена представляет собой ферментативно активный пепсин ( мол. В желудке пепсин гидроли-зует те пептидные связи в белках, которые образованы ароматическими аминокислотами-тирозином, фенилалани-ном и триптофаном, а также рядом других ( табл. 24 - 1); в итоге из длинных полипептидных цепей образуется смесь более коротких пептидов. [37]
Так, химотрипсин и прокарбоксипеп-тидаза активируются трипсином; трипсиноген - также трипсином или энтеропептидазой; пепсиноген - пепсином или ионами водорода ( при подкислении среды); прореннин - ионами водорода. Процесс, естественно, имеет автокаталитический характер и скорость его стремительно нарастает. [38]
Пепсин, трипсин и химотрипсин выделяются слизистой оболочкой желудка и поджелудочной железой в форме зимогенов ( пепсиноген, трипсиноген и химотрипсиноген), по-видимому, чтобы предотвратить переваривание ими белков тех клеток, которые их вырабатывают. [39]
Превращение пепсиногена в пепсин катализируется ионами водорода; поэтому можно полагать, что оно осуществляется после перехода пепсиногена в сильно кислый желудочный сок. Роль катализатора в этой реакции играет, по-видимому, сам пепсин. Реакция активации является, таким: образом, аутокаталитической. Поскольку молекулярный вес пепсина равен 35 000, превращение пепсиноген - - пепсин связано со значительным укорочением полипептидной цепи. Оно происходит за счет отщепления N-концевого участка пепсиногена, в котором сосредоточены все основные аминокислоты. Связи, по которым атакует пепсин, показаны на фиг. [40]
С помощью достаточного количества соляной кислоты в измельченной ткани устанавливается кислотность, при которой происходит быстрое превращение пепсиногена в пепсин и предотвращается разрушение пепсиногена и пепсина другими тканевыми протеиназами. [41]
Поступление пищевого белка в желудок стимулирует секрецию гормона гастрина, который в свою очередь стимулирует секрецию НС1 и пепсиногена в клетках слизистой оболочки. [42]
Пока не начнется секреция желудочного сока, пепсин ( про-теолитический фермент желудочного сока) находится в неактивной форме, называемой пепсиногеном. Полагают, что превращение происходит в результате незначительного расщепления белковой молекулы пепсиногена. Возможно, что при этом обнажается активный центр, который до этого находился внутри молекулы. [43]
В разных лабораториях с начала 50 - х годов проводились интесивные исследования по расшифровке строения различных белков, в том числе пепсиногена и пепсина [31, 250], трипсиногена и триписина [143], а-химотрипсиногена и а-химотрипсина [346, 347], карбоксипептидазы [428], лизоцима [68], белка цитохро-ма с [438], сукциндегидрогеназы [270], яичного [416] и сывороточного альбуминов [471], гемоглобина [357], белка вируса табачной мозаики [393] и многих других. [44]
С помощью достаточного количества соляной кислоты в измельченной ткани устанавливается кислотность, при которой происходит быстрое превращение пепсиногена в пепсин и предотвращается разрушение пепсиногена и пепсина другими тканевыми протеиназами. [45]
Страницы: 1 2 3 4

