Пептидаз
Cтраница 1
Пептидазы действуют только на пептиды, причем они обладаь большой специфичностью действия. Их действие на субстрат завис ] от расположения в нем отдельных химических группировок. По хара теру своего действия они делятся на аминопептидазы и карбокс пептидазы. [1]
Пептидазы - ферменты, гидролизующие пептидные ( - СО - - NH -) связи. [2]
Пептидазы обладают очень большой специфичностью действия и делятся на три группы: аминопептидазы, кар-боксипептидазы и дипептидазы. [3]
Пептидазы делятся обычно па амино -, карбокси - и дипептидазы. [4]
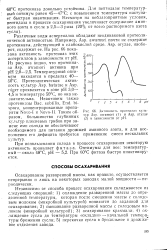 |
Активность протеиназ культур Asp. awamori ( 1 и Asp. oryzae ( 2 в зависимости от рН. [5] |
Для пептидазы температурный оптимум равен 45 - 47 С; с повышением температуры наступает быстрая инактивация. [6]
Протеазы и пептидазы обнаружены не только в составе пищеварительных соков, но и во многих животных и некоторых растительных тканях. Протеаза животных тканей - катепсин ускоряет гидролиз белков, находящихся в изоэлектрическом или близком к изоэлектрическому состояниях. Оптимум активности катепсина лежит при 4 - 5; при рН - 7 0 он неактивен. Поэтому действие катепсина становится особенно заметным при посмертном автолизе тканей, когда [ Н ] тканей повышается. Катепсин активируется соединениями, содержащими сульфгидрильные группы. Катепсин гидролизует белки с образованием альбумоз и пептонов. В тканях катепсин находится, обычно, вместе с пептидазами и дипептидазами. Он найден во многих животных тканях, но особенно богаты им ткани печени, почек и селезенки. По некоторым данным катепсин встречается также в составе желудочного сока. [7]
 |
Две возможные роли остатка Glu-270 при гидролизе. основной катализ атаки водой ( а и образование промежуточного ангидрида ( б. [8] |
Карбоксипептидаза А и другие пептидазы. [9]
Обычно протеазы разделяют на пептидазы и протеи-назы. Первые катализируют расщепление тех пептидных связей, которые соединяют концевые остатки аминокислот с главной полипептидной цепью, а вторые - пептидные связи, удаленные от концевых остатков аминокислот в пептидной цепи. [10]
Классификация протеаз на протеиназы и пептидазы обоснована с физиологической, но не с химической точки зрения. Точное исследование специфичности протеаз показало, что пепсин и трипсин гидролизуют не только природные белки, как было принято считать, но и низшие пептиды, если последние состоят из определенных аминокислот. Специфичность различных ферментов могла быть установлена ( вследствие их выделения в чистом виде) исследованием их действия на большое числе пептидов, полученных из различных аминокислот ряда L, методом карбобензилоксилирования. Бергманом и его школой после 1932 г.) установлено, что все протеазы являются, по существу, пептидазами. [11]
Две большие группы гидролаз ( пептидазы и фосфатазы) обсуждаются в гл. Эти две группы включают некоторые хорошо изученные металлоферменты, например карбокси-пептидазы и щелочную фосфатазу. Описан и ряд других металло-гидролаз. [12]
Протеазы подразделяют на протеиназы и пептидазы. Протеина-зы ведут гидролиз непосредственно нативных ( природных) белков. [13]
Цинк входит в состав фосфатазы, пептидазы и других ферментов растений. Кроме того, он участвует в синтезе гетероауксина, регулирующего рост растений. Поэтому при недостатке в почве соединений цинка наблюдаются существенные отклонения в росте и развитии растений. [14]
Конъюгаты с глутатионом подвергаются действию у-глут-амилтрансферазы, пептидазы, ацетилазы; в метаболизме этих конъ-югатов участвует кофермент А. [15]
Страницы: 1 2 3 4