Большинство - органическая молекула
Cтраница 1
Большинство органических молекул имеют несколько реакционны. Поэтому превращения с участием таких молекул могут яря вести к смеси структурных изомеров. Однако варьированием усломй реакции удается так управлять ее ходом, что реагент атакует толис один реакционный центр с образованием только одного ( или преимущественно одного) структурного изомера. [1]
 |
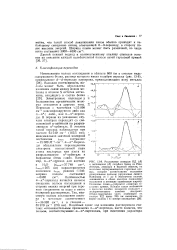
Зависимость наблюдаемого объема элементарной ячейки У различных органических металлов типа ( TMTSF2. Y от среднего расстояния между атомами Se в различных стопках ( d при Т 125 К. [2] |
Большинство органических молекул в кристаллах, которые проявляют металлическую проводимость, являются планарными с симметрией D2 / l и упаковываются параллельными слоями в стопки, вдоль которых электропроводность максимальна ( см. разд. [3]
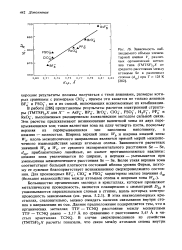
Большинство органических молекул диамагнитно, причем диамагнетизм особенно силен, если молекулы ароматические. Например, в бензольном кольце, помещенном в магнитное поле Н, перпендикулярное его плоскости, возникает ток, стремящийся уменьшить поток сквозь кольцо. При этом силовые линии стремятся вытолкнуться, как показано на фиг. С другой стороны, если поле Н приложено параллельно кольцу, ток не возникает, силовые линии остаются почти неискаженными и энергия не увеличивается ( фиг. Таким образом, молекула бензола стремится ориентироваться так, чтобы Н было в плоскости кольца. [4]
Большинство органических молекул не фосфоресцирует в жидких растворах, поэтому для исследования их триплетных состояний приходилось применять косвенные методы, например сенсибилизацию фосфоресценции диацетила. [5]
Большинство органических молекул имеют более сложное строение, чем молекулы неорганические. Поэтому найти для органических соединений простые количественные зависимости свойств от физических констант, таких как потенциалы ионизации, сродство к электрону, электроотрицательность, электрический момент диполя, поляризуемость, заряд и радиус, в отличие от неорганических соединений, не представляется возможным. Поэтому вместо физических параметров молекул используются физико-химические, такие как константы скорости и константы равновесия при стандартных условиях. [6]
Поскольку большинство органических молекул содержит и полярные и не-поляриые группы, следует ожидать, что растворимость будет зависеть от соотношения, этих групп. При увеличении углеводородной части молекулы свойства соединения приближаются к свойствам соответствующего углеводорода, производным которого является данное соединение. Это означает, что его растворимость в воде уменьшается, а растворимость в эфире увеличивается. Аналогичные изменения в растворимости происходят при увеличении числа ароматических колец в соединении. [7]
Поскольку большинство органических молекул содержит и полярные и не-поляриые группы, следует ожидать, что растворимость будет зависеть от соотношения, этих групп. При увеличении углеводородной части молекулы свойства соединения приближаются к свойствам соответствующего углеводорода, производным которого является данное соединение. Это означает, что его растворимость в воде уменьшается, а растворимость в эфире увеличивается. Аналогичные изменения в растворимости происходят при увеличении числя ароматических колец в соединении. [8]
В большинстве органических молекул каждый атом углерода связан спин-спиновым взаимодействием с протонами этой же молекулы. [9]
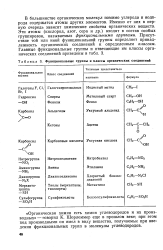 |
Функциональные группы и классы органических соединений. [10] |
В большинстве органических молекул помимо углерода и водорода содержатся атомы других элементов. Именно от них в первую очередь зависят химические свойства органических веществ. Эти атомы ( кислород, азот, сера и др.) входят в состав особых группировок, называемых функциональными группами. Присутствие той или иной функциональной группы определяет принадлежность органических соединений к определенным классам. [11]
В большинстве органических молекул все электроны в основном состоянии спарены, и, согласно принципу Паули, электроны внутри пары имеют противоположные спины. Когда один электрон из пары переходит на орбиталь с более высокой энергией, в принципе возможны две ситуации: этот электрон может иметь такой же спин, как и его бывший партнер, или противоположный спин. [12]
В большинстве органических молекул основное состояние является синглетным, а триплеты обладают избытком энергии. Поэтому распространено мнение, что в реакциях возбужденных состояний всегда участвуют триплеты органических молекул из-за их высокой реакционной способности. [13]
Электронные переходы у большинства органических молекул относятся к другому типу. Переходы с частотами 55 000 см - классифицируются либо как я-л - ; либо, как п-я - перехо-ды. В первом из указанных случаев электрон переходит со связывающей я-орбитали на разрыхляющую я - орбиталь. В этилене такой переход наблюдается при частоте 61540 см 1 ( 162 5 нм); максимальное значение молярной экстинкции emax составляет - 15000 М-1-см-1, п-л - Перехо-ды обусловлены перемещением электрона неподеленной пары атома кислорода или азота на разрыхляющую я - орбиталь и выражены очень слабо. [15]
Страницы: 1 2 3 4