Большинство - белок
Cтраница 3
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. [31]
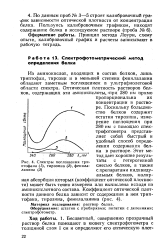 |
Спектры поглощения триптофана ( / ланина ( 3. [32] |
Поскольку большинство белков содержит остатки тирозина, измерение поглощения при 280 нм с помощью спектрофотометра представляет собой быстрый и удобный способ определения содержания белка в растворе. Этот метод дает хорошие результаты с гетерогенной смесью белков, а также с препаратами индивидуальных белков, молярная абсорбция которых ( коэффициент оптической плотности) может быть точно измерена или вычислена исходя из аминокислотного состава. [33]
Для большинства белков изоэлектрическая точка близка к нейтральной среде, но несколько сдвинута в кислую сторону. Это объясняется тем, что кислотные свойства у них преобладают над щелочными и в нейтральном растворе они реагируют как слабые кислоты. Молекула таких белков содержит больше свободных карбоксильных групп, чем аминных, а при гидролизе дает преобладание дикарбоновых и других кисло реагирующих аминокислот над теми, у которых преобладают основные свойства. Некоторые белки, наоборот, относительно богаче аминными группами и в своем составе содержат больше остатков ди-аминокислот. В нейтральном растворе они ведут себя как слабые основания. Такие белки ( например, гистоны и про-тамины) имеют изоэлектрическую точку при слабо щелочной реакции. [34]
Для большинства белков ИЭТ лежит в области кислых растворов. Положение ИЭТ зависит от наличия солей в растворе. Некоторые анионы, например CNS -, сдвигают ее в кислую сторону, а катионы, особенно многовалентные, - в щелочную. Изменение свойств растворов белков вблизи ИЭТ связано с изменением формы белковых макромолекул. Их форма имеет резко выраженную зависимость от рН среды. [35]
Растворимость большинства белков зависит от ионной силы, рН я концентрации органических растворителей. Рассмотрим влияние каждого из из этих факторов. [36]
Плотность большинства белков составляет примерно 1 33 г / мл, поэтому даже при плотности раствора 1 15 г / см3 они будут оседать на дно пробирки. Для более тонкого разделения частиц по плотности необходимо применение градиента плотности. [37]
Денатурация большинства белков приводит к увеличению гидрофобности их поверхности за счет экспонирования ранее недоступных для растворителя остатков гидрофобных аминокислот. Нуклеози-ды, а тем более нуклеотиды и нуклеиновые кислоты более гидрофильны за счет остатков Сахаров и ( особенно) фосфорной кислоты. [38]
В большинстве белков приблизительно для 15 % атомов водорода время обмена превышает 24 час. Поскольку данные табл. 13 рассчитаны по полосам поглощения в инфракрасной области, соответствующим колебаниям в пептидных группах, их следует считать относящимися к атомам, входящим в состав остова полипептидной цепи. Обмен этих атомов происходит медленно, так как они участвуют в водородных связях или находятся в гидрофобных областях, недоступных для растворителя. Для инсулина и рибонуклеазы содержание спиральных форм, приведенное в табл. 13, больше содержания всех медленно обменивающихся атомов водорода, измеренного по методу плотности, и меньше приведенных выше величин, рассчитанных - в предположении чт & все медленно обменивающиеся - атомы-ве - - дорода принадлежат остову полипептидной цепи. [39]
Пепсином гидролизуется большинство высокомолекулярных белков, за исключением фиброина шелка, кератинов, спонгина, конхиолина, муцина и овомукоида. [40]
Зависимость растворимости большинства белков от рН при данной ионной силе описывается U-образной кривой с минимумом вблизи изо-электрической точки. Соответствующие кривые для [ 3-лактоглобулина приведены на фиг. [41]
Поскольку растворимость большинства белков вблизи их изоэлектрической точки оказывается минимальной, можно подобрать такое значение рН, при котором нужный белок выпадет в осадок, а большинство загрязняющих белков останется а растворе. [42]
В состав большинства белков входит а. [43]
Аналитический состав большинства белков колеблется в сравнительно узких пределах. Белки содержат 50 - 55 % углерода, 6 5 - 7 3 % водорода, 15 - 18 % азота, 21 - 24 % кислорода, 0 - 2 4 % серы и, как правило, золу. В то же время характер и количество отдельных составных частей, из которых построены белки, очень различны. [44]
Аналитический состав большинства белков колеблется в сравнительно узких пределах. Белки содержат 50 - 55 % углерода, 6 5 - 7 3 % водорода, 15 - 18 % азота, 21 - 24 % кислорода, 0 - 2 4 % серы и, как правило, золу. В то же время характер и количество отдельных составных частей, из которых построены белки, очень различны. [45]
Страницы: 1 2 3 4