Большинство - белок
Cтраница 2
Большинство белков выделяется из водных растворов солями щелочных или щелочноземельных металлов, не подвергаясь при этом денатурации. Так как многие белки по-разному относятся к высаливающим средствам ( солям), то таким путем часто удается их разделять. Для высаливания белков применяют хлорид и сульфат натрия, ацетаты натрия, калия, нитрат кальция, сульфаты магния, аммония, цинка и другие соли. Некоторые из них осаждают белки, даже будучи прибавлены к раствору в небольшом количестве, что может быть с успехом ирпользовано для дробного выделения белков. [16]
Большинство белков известно в аморфном состоянии. Кристаллизоваться могут альбумин куриного яйца, гемоглобин крови и некоторые другие. Отношение белков к воде неодинаково: одни растворяются в ней, другие нет. В органических растворителях-абсолютном спирте, эфире и хлороформе - все они не растворяются. [17]
Большинство белков может быть иммобилизовано в мягких условиях на CNBr-активированной агарозе или агарозе, активированной другим методом. [18]
Большинство белков устойчиво только в относительно узких пределах рН и быстро денатурируется при подкислении или подщелачива-нии растворов. Значение рН, при котором белок максимально устойчив, наиболее близко к значению рН нейтрального раствора и необязательно совпадает с изоэлектрической точкой белка. [19]
Большинство белков поглощает ультрафиолетовое излучение с длиной волны около 280 тр. Было показано1 [91-94], что это поглощение обусловлено тирозином, триптофаном и ( в меньшей степени) фенилаланином. Таким образом, величина поглощения зависит от содержания этих аминокислот в белке. Измерение оптической плотности белкового раствора при 280 пу служит удобным и точным методом определения концентрации белка [95], если известен коэффициент экстинкции и в растворе нет других веществ, поглощающих свет с этой длиной волны. Рассматриваемый метод можно также применять для приближенного измерения общего содержания белков в смеси в тех случаях, когда допустимо использование среднего коэффициента экстинкции. Метод имеет то преимущество, что на поглощение света не влияют растворенные соли и многие другие вещества и что, следовательно, определение можно производить на образцах белковых фракций без всякой специальной их подготовки, Анализ производится быстро, причем требуются всего лишь доли миллиграмма белка. [20]
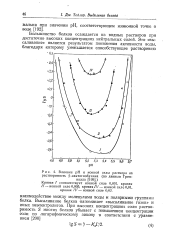 |
Влияние рН и ионной силы раствора на растворимость 3-лактоглобулина ( по данным Грен. [21] |
Большинство белков осаждается из водных растворов при достаточно высоких концентрациях нейтральных солей. [22]
Большинство белков выделяется из водных растворов солями щелочных или щелочноземельных металлов, не подвергаясь при этом денатурации. Так как многие белки по-разному относятся к различным высаливающим средствам ( солям), то таким путем часто удается их разделять. Для высаливания белков приме няют хлористый натрий, сернокислый натрий, уксуснокислый натрий, уксуснокислый калий, сернокислый магний, азотнокислый кальций, сернокислый аммоний, сернокислый цинк и другие соли. Некоторые из них осаждают белки даже будучи прибавлены к раствору в небольшом количестве, что может быть с успехом использовано для дробного выделения белков. [23]
Большинство белков при кипячении с водой, при действии крепкого спирта или кислоты, резко изменяется, свертывается. [24]
Большинство белков дает милло-нову реакцию, так как в их состав входит аминокислота тирозин, являющаяся одновременно фенолом. [25]
Большинство белков с молекулярной массой более 20000 - 30000 обладает, однако, четвертичной структурой и состоит из нескольких индивидуальных субъединиц, которые связаны между собой за счет неко-валентных сил. Гемоглобин, например, состоит из четырех единиц, каждая из которых состоит из отдельной полипептидной цепи, а вирус табачной мозаики имеет более 2000 отдельных полипептидных цепей. Наконец, отметим, что хотя такие субъединицы из различных источников сильно варьируют по размеру, многие из них, например из гемоглобина человека, соответствуют примерно размеру субъединицы в 17600 ( полипептидная цепь из 150 аминокислотных остатков), как это впервые предположил Сведберг [10], и они подчиняются сведберговскому закону кратности. Объединение таких белковых субъединиц с воссозданием полностью активного биологического комплекса обычно называют четвертичной структурой белка. Изучение взаимодействия субъединиц является чрезвычайно важным аспектом современной молекулярной биологии, так как эти взаимодействия несомненно играют важную роль во многих биологических реакциях. Современными классическими примерами влияния таких свойств на биологические явления слу - - жат аллостерическое поведение ферментов и кооперативность связывания кислорода в гемоглобине. Тетрамерная структура гемоглобина содержит четыре участка, связывающих кислород, и эта структура такова, что когда один из участков связывает кислород, то небольшие изменения в конформации полипептидной цепи вокруг этого участка передаются на следующий участок с тем, чтобы увеличить его сродство к кислороду. Как только произойдет связывание кислорода каждым из первых трех участков, аналогичный эффект наблюдается на следующем участке. Такое поведение чрезвычайно важно для характеристики гемоглобина как переносчика кислорода. [26]
Большинство белков растений неполноценны, и дефицитной аминокислотой чаще всего является лизин. В белках животного происхождения имеет место дефицит по метионину, триптофану, лизину, изолейцину и тирозину. [27]
Поскольку большинство белков переваривается пепсином или трипсином, вполне понятно, что белки теряют свои антигенные свойства при прохождении через пищеварительный канал. Поэтому, чтобы вызвать образование антител, необходимо вводить белки парентерально. [28]
Однако большинство белков не имеет нитевидного или фибриллярного строения. Ферменты, белковые гормоны и все белки крови, за исключением фибриногена, относятся к глобулярным белкам. Такое изменение растворимости называется денатурацией. Изучение строения таких измененных белков показало, что они уже больше похожи на фибриллярные белки. При денатурации фермент или гормон обычно утрачиваются характерные для них биологические свойства. [29]
Страницы: 1 2 3 4
