Одноэлектронный переход
Cтраница 1
Одноэлектронные переходы ipi - if3 и з2 - ц имеют одинаковую энергию и дипольные моменты одинаковой величины и направления, благодаря свойству парности молекулярных я-орбиталей. Переходные моменты направлены вдоль оси Z. Их величина максимальна для плоской s - цис-конформации и равна нулю в плоской s - гракс-конформации. [1]
Описание одноэлектронных переходов ( рис. 9) путем перескока электрона с одной орбитали на другую имеет несколько существенных недостатков. Во-первых, нет указаний на то, что энергии молекулярных орбиталей, вообще говоря, различаются в основном и возбужденном состояниях. Например, после / г-л - перехода энергия оставшегося n - электрона, вероятно, ниже, чем была до возбуждения, так как л-электроны могут перемещаться по направлению к слабо положительной дырке в атоме кислорода карбонильной группы из-за электростатического притяжения и возникает относительное повышение электронного ( отрицательного) заряда на углероде из-за электрона на я - орбитали. [2]
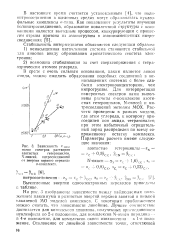 |
Зависимость v макс полос спектров растворов азотистых гетероциклов, N-окисей. нитросоединетш от энергии первого перехода сг-комплекса. [3] |
Вычисленные энергии одноэлектронных переходов приведены Б таблице. [4]
Представление об одноэлектронных переходах было использовано и в последних работах по выделению и растворению металлов на жидком электроде. К этому времени уже стало понятно, что выяснение механизма электродных процессов выделения - растворения металлов было возможно только при условии взаимосвязанного изучения кинетики и катодного и анодного процессов, причем изучение следовало проводить в одной и той же области потенциалов, так как в другой области потенциалов состояние поверхности электрода могло быть существенно отличным, а следовательно, отличным мог быть и механизм. Например, могли различаться заряд поверхности и связанная с ним адсорбция анионов; также могла различаться величина адсорбции кислорода и других атомов, вызывающих хотя бы частичную пассивацию металла. [5]
Температурный коэффициент ЭДС гальванического элемента с одноэлектронным переходом равен нулю. [6]
В случае замедленного разряда коэффициент переноса для одноэлектронного перехода равен отношению энергии активации электрохимического процесса w к электрохимической работе перехода заряженной частицы fq ( где F - число Фарадея, р - равновесная разность потенциалов), или, что то же, равен доле электродного потенциала, благоприятствующей протеканию катодного процесса. [7]
 |
Потенциалы полуволны E k первой so we восстановлений некоторых к р ненасыщенных и насыщенных карбонильные соединений. [8] |
В идеальных случаях наблюдается серия из четырех последовательных одноэлектронных переходов; часто две первые или две последние стадии сливаются в одну двухэлектронную стадию. [9]
SjLjSL, то нетрудно найти также полные эффективные сечения одноэлектронных переходов nl - Е и Е - nl для многоэлектронных атомов. [10]
Авторы пришли к выводу, что эта полоса соответствует одноэлектронному переходу в ионной паре, при котором образуется нейтральный гетероциклический радикал с избыточным р-электроном. Характерно, что переход к менее полярным растворителям обнаруживает тенденцию к сдвигу полосы переноса электрона в сторону больших длин волн. [11]
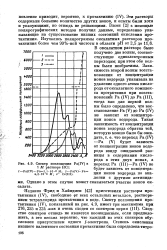 |
Спектр поглощения Pa ( IV в 1 М растворе НС1. [12] |
В оксалатном растворе было получено две волны, соответствующие одноэлектронным переходам; при этом обе волны были необратимы. Зависимость второй волны восстановления от концентрации ионов водорода указывала на удаление одного атома кислорода от оксалатно го комплекса протактиния при восстановлении Ра ( IV) до Ра ( III), тогда как для первой волны было определено, что восстановление Ра ( V) до Ра ( IV) не зависит от концентрации ионов водорода. Ра ( IV) - Ра ( V) будет зависеть от концентрации ионов водорода ввиду ожидаемой разницы в содержании кислорода в этих двух ионах, а переход Ра ( III) - Ра ( IV) не будет зависеть от концентрации ионов водорода по аналогии с другими актинидами. Однако в этом случае может сказываться участие ионов ок-салата. [13]
Окислительно-восстановительный катализ наблюдается в радикальных процессах и связан с одноэлектронными переходами между катализатором и реагентами. В качестве катализаторов используются металлы 4 - 6 периодов таблицы Менделеева с незаполненными d - обо-лочками ( Pt, Ni, Co, Mn, Fe и др.), а также некоторые их оксиды и сульфиды. [14]
При применении окислительно-восстановительных систем инициирование полимеризации происходит в результате реакций типа одноэлектронного перехода; такие реакции могут быть исследованы различными методами. [15]
Страницы: 1 2 3 4