Другой фазовый переход
Cтраница 2
 |
I. Схематическое изображение. [16] |
Изменение в данном случае вида, например, других фазовых переходов первого или второго родов носит название перехода поведения; оно имеет особое значение в случаях ориентации полимеров из некристаллического состояния. Переход поведения не есть что-то присущее только полимерам. Обычно он связан с механическим или гидродинамическим полем и в большой системе макромолекул может менять порядок обычных переходов так же, как электромагнитные поля меняют порядок ферромагнитных или сверхпроводящих переходов. [17]
Причины мартенситного превращения аустенита те же, что и всех других фазовых переходов в твердом состоянии, а именно: ниже определенной температуры существует состояние сплава, обладающее меньшей свободной энергией ло сравнению с высокотемпературным состоянием. Так как мартенситное превращение происходит без изменения концентрации твердого раствора, то его можно рассматривать как превращение в однокомпонентной системе. Свободная энергия каждой из этих модификаций ( FA и FM) имеет свою температурную зависимость. [18]
Для фазового перехода в сегнетоэлектрике, так же как и для других фазовых переходов II рода, характерно отсутствие перегретых и переохлажденных состояний. В этом заключается одно из существенных отличий фазовых переходов II рода от фазовых переходов I рода. Причину этого отличия нетрудно проследить, рассматривая кривую свободной энергии как функцию внутреннего параметра К системы. Она имеет два минимума. Состояния вещества, отвечающие каждому из этих двух минимумов, локально устойчивы и равновесны. Этим состояниям соответствуют две фазы вещества. С термодинамической точки зрения эти фазы неравноценны: фаза, отвечающая первому минимуму, имеет меньшую свободную энергию, чем вторая. Поэтому термодинамически устойчивой является первая фаза. Что касается второй фазы, то, хотя она и энергетически менее выгодна, из-за локальной устойчивости она может существовать достаточно долго. Время ее существования определяется временем ожидания тепловой флуктуации, необходимой для преодоления барьера. Вследствие макроскопического характера барьера это время имеет макроскопический порядок величины. Поэтому вторая фаза является метастабильной, а вещество в этом состоянии - перегретым или переохлажденным. При изменении температуры взаимное расположение минимумов на кривой меняется. Температура, при которой энергии в минимумах совпадают, отвечает температуре фазового перехода. [19]
С этой точки зрения между критической точкой жидкость - пар и другими фазовыми переходами существует глубокая аналогия. [20]
С высокой колокольни свободной энергии плавление и кристаллизация ничуть не более таинственны, чем любой другой фазовый переход. [21]
Основой тепловых технологических расчетов являются такие теплофизические характеристики веществ, как теплота парообразования и других фазовых переходов, теплоемкость, теплопроводность. Для расчета тепловых эффектов химических реакций необходимо знание теплоты сгорания и теплоты образования компонентов реакционной смеси. [22]
Уравнение Клапейрона - Клаузиуса справедливо не только для перехода жидкость - пар, но и для всех других фазовых переходов. Оно выражает изменение давления, при котором фазы находится в равновесии, с изменением температуры. [23]
В более точной теории нужно учесть возможность перехода сплава во вполне неупорядоченное состояние при более высокой температуре другого фазового перехода, что приведет к добавочным особенностям коэффициента диффузии. Теория диффузии при такой более общей постановке задачи сильно усложняется. [24]
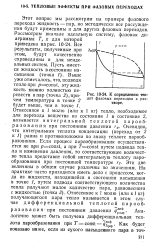 |
К определению теп. [25] |
Этот вопрос мы рассмотрим на примере фазового перехода жидкость - пар, но методически все рассуждения будут применимы и для других фазовых переходов. Все результаты, полученные при этом, будут качественно справедливы и для неидеальных систем. Выше уже отмечалось, что, подводя тепло при pconsi, эту жидкость можно полиостью перевести в пар ( точка 2) причем температура в точке 2 будет выше, чем в точке /, Отнесенное к 1 молю ( или к 1 кг) тепло, необходимое для перехода вещества из состояния / в состояние 2, называется интегральной теплотой парообразования при постоянном давлении гр. Очевидно, что интегральная теплота конденсации ( переход от 2 к /) равна и противоположна по знаку теплоте парообразования. Если процесс парообразования осуществляется не цри pconsi, а при Theorist путем подвода тепла и изменения давления, то соответствующее количество тепла представит собой интегральную теплоту парообразования при постоянной температуре гт. Эти две величины в общем случае различны по значениям. [26]
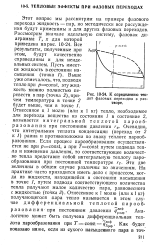 |
К определению теп. [27] |
Этот вопрос мы рассмотрим на примере фазового перехода жидкость - пар, но методически все рассуждения будут применимы и для других фазовых переходов. Все результаты, полученные при этом, будут качественно справедливы и для неидеальных систем. Выше уже отмечалось, что, подводя тепло при pconsi, эту жидкость можно полиостью перевести в пар ( точка 2) причем температура в точке 2 будет выше, чем в точке /, Отнесенное к 1 молю ( или к 1 кг) тепло, необходимое для перехода вещества из состояния / в состояние 2, называется интегральной теплотой парообразования при постоянном давлении гр. Очевидно, что интегральная теплота конденсации ( переход от 2 к /) равна и противоположна по знаку теплоте парообразования. Если процесс парообразования осуществляется не цри pconsi, а при Theorist путем подвода тепла и изменения давления, то соответствующее количество тепла представит собой интегральную теплоту парообразования при постоянной температуре гт. Эти две величины в общем случае различны по значениям. [28]
 |
К определению теп. [29] |
Этот вопрос мы рассмотрим на примере фазового перехода жидкость - пар, но методически все рассуждения будут применимы и для других фазовых переходов. Все результаты, полученные при этом, будут качественно справедливы и для неидеальных систем. Выше уже отмечалось, что, подводя тепло при / 7const, эту жидкость можно полностью перевести в пар ( точка 2), причем температура в точке 2 будет выше, чем в точке 1, Отнесенное к 1 молю ( или к 1 кг) тепло, необходимое для перехода вещества из состояния / в состояние 2, называется интегральной теплотой парообразования при постоянном давлении гр. Очевидно, что интегральная теплота конденсации ( переход от 2 к 1) равна и противоположна по знаку теплоте парообразования. [30]
Страницы: 1 2 3 4