Пероксидные
Cтраница 2
Первичными стабильными продуктами окисления угля могут быть как пероксидные, так и фенольные группы. При их разложении образуются карбонильные, а затем карбоксильные группы. Механизм процесса окисления углей весьма сложен из-за наличия многофункциональных заместителей у ароматического ядра структурных единиц. В то же время образование ароматических кислот из углей свидетельствует о том, что, по-видимому, механизм реакций окисления их веществ тождествен механизму окисления индивидуальных многоядерных ароматических соединений, например антрацена. [16]
Третье и четвертое уравнения получают, используя обработку пероксидных производных фенилсульфидом и метил - п-толилсульфидом. [17]
В книге рассмотрены вопросы теории и практики анализа органических пероксидных ( перекисных) соединений всех основных классов: гидропероксидов, пер-кислот, пероксидов алкилов и ацилов, перэфиров и пе-роксипроизводных, образующихся из карбонильных соединений. [18]
Описано несколько взрывов и пожаров, происшедших при контакте пероксидных производных метилэтилкетона с ускорителями при смешении плохо перемешанного раствора пероксидных производных кетонов в полиэфирной смоле с нафтена-том кобальта. Известен случай самопроизвольного взрыва пер-муравьиной кислоты после ее смешения с органическим веществом. [19]
Отверждение полиэфирных смол протекает по радикальному механизму к присутствии пероксидных ( пероксид бензоила и др) или других инициаторов при 350 - 420 К. [20]
В начале процесса окисления количество поглощенного кислорода эквивалентно количеству образующихся пероксидных соединений, однако на более поздних стадиях продолжения цепи такая - закономерность нарушается: кислорода поглощается больше, чем требовалось бы, исходя из наличия пероксидов. Это подтверждает тот факт, что на ранних стадиях окислительных превращений пероксиды являются основными продуктами, а на более поздних значительную р ль начинают играть кислородсодержащие соединения. [21]
Восстановление ионом двухвалентного железа применяется для количественного определения легко восстанавливаемых пероксидных соединений, главным образом алкилгидропероксидов, которые образуются при прогорка-нии жиров и в других аутоокислительных процессах. Такой анализ следует проводить в строго контролируемых условиях, иначе результаты получаются неточными и невоспроизводимыми. Необходимо тщательно удалять кислород; влияние растворителя обычно велико, но трудно объяснимо; пероксидное соединение может расходоваться и в побочных реакциях помимо окисления ионов двухвалентного железа. В силу этих осложнений восстановление ионом двухвалентного железа применяется для колориметрического определения следов пероксидных соединений в тех случаях, когда абсолютные величины не представляют интереса. [22]
Восстановление ионом двухвалентного железа применяется для количественного определения легко восстанавливаемых пероксидных соединений, главным образом алкилгидропсроксидов, которые образуются при прогорка-нии жиров и в других аутоокислительных процессах. Такой анализ следует проводить в строго контролируемых условиях, иначе результаты получаются неточными и невоспроизводимыми. Необходимо тщательно удалять кислород; влияние растворителя обычно велико, но трудно объяснимо; пероксидное соединение может расходоваться и в побочных реакциях помимо окисления ионов двухвалентного железа. [23]
Обычно в условиях жидкофазного окисления алкильные радикалы быстро превращаются в пероксидные и не участвуют в других превращениях. Однако, если [02] мала ( при низком парциальном давлении кислорода или из-за высокой скорости окисления, соизмеримой со скоростью растворения О2), то алкильные радикалы могут участвовать и в других реакциях, в частности в реакциях обмена с углеводородами в многокомпонентной системе. Относящиеся сюда факты были впервые открыты в работе [93] на примере сопряженного окисления w - декана и этилбензола. Как и следовало ожидать, окисление и-дскана ускоряется, но при дальнейшем увеличении этилбензола в смеси скорость расходования - декана снижается, а при содержании этилбензола 10 % и более - декан практически не расходуется, и окисляется только этилбензол. [24]
 |
Химическая релаксация напряжения OT / CTO пероксидных ( 1 - 3 и полисульфидных ( 4 - 6 вулканизатов натурального каучука в вакууме ( /, 4 и на воздухе ( 2, 3, 5, 6. [25] |
Вулканизаты с полисульфидными связями характеризуются падением напряжения по экспоненциальной зависимости значительно быстрее, чем пероксидные. Вследствие распада полисульфидных связей имеет место падение напряжения и в вакууме. [26]
Они производятся от шестн-валентиых элементов к содержат в кислотном радикале от 1 до 4 пероксидных ryynn - О - О - , замещающих отдельные атомы кислорода. В водной среде все Пероксидные производные Сг, Мо и W более или менее неустойчивы. [27]
При концентрации растворенного кислорода 10 - 3 моль / л практически все алкильные радикалы превращаются в пероксидные, за исключением углеводородов, образующих стабильные алкильные радикалы, например 2 5-диметил - 2 5-гептадиена, трифенил-метана. [28]
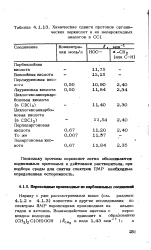 |
Химические сдвиги протонов органических перкислот и их непероксидных аналогов в СС1. [29] |
Наряду с уже рассмотренными выше ( см. разделы 4.1.2 и 4.1.3) известны и другие исследования по спектрам ЯМР пероксидных производных из альдегидов и кетонов. [30]
Страницы: 1 2 3 4