Пероксиэфир
Cтраница 1
Пероксиэфиры образуются из карбоновой кислоты и гидропероксида с сохранением пероксидной группы О - О, что подтверждается гидролизом m / jem - бутилпероксиэфиров, который протекает через то же переходное состояние, что и прямая реакция. Гидролиз осуществляется при существенно более высоких температуре и концентрации минеральной кислоты, чем реакция этерификации. [1]
Пероксиэфир выделяют, растворяя в пентане. Непрореагировавший гидропероксид экстрагируют водой. Растворитель отгоняют под вакуумом. [2]
Пероксиэфиры, производные аралкилгидроперекисей, считаются хорошими инициаторами низкотемпературной полимеризации для получения слабоокрашенных высокомолекулярных про-дукто в. Когда реакция протекает с участием хлорангидридов, для связывания кислоты можно применять пиридин и бикарбонат натрия. Таким способом были получены эфиры из хлорангидридов моно - и дикар-боновых кислот и гидроперекисей кумола, цимола и диизопро-пилбензола. Реакция проводится при комнатной температуре в растворе бензина. [3]
Пероксиэфиры в зависимости от их строения и условий разлагаются по гемолитическому или гетеролитическому механизму, Разложение пероксиэфиров, полученных из первичных или вторичных гидропероксидов, идет со значительной скоростью уже при комнатной температуре с образованием кислоты и карбонильного соединения. В отличие от бензоилпероксида для трелг-бутилпероксибензоата индуцированное разложение не характерно. На скорость гемолитического разложения пероксиэфира существенно влияет структура ацильного остатка [49], Так, в хлорбензоле пероксиэфиры при 60 С имеют период полураспада ( в мин. Такое ускорение разложения сопровождается уменьшением энтропии активации, что связано с ограничением вращения в пероксиэфирной группировке и возможностью ее расположения в одной плоскости с л-электронной системой радикала R в переходном состоянии. [4]
Пероксиэфиры легко реагируют с нуклеофильными реагентами, атакующими электрофильныи атом углерода пероксиаццльного остатка. [5]
Если пероксиэфир А, в котором карбонильный атом кислорода мечен 180, подвергнуть серии превращений, показанных на схеме, то весь 180 будет обнаружен в бензиловом спирте. Перегруппировка А - Б представляет собой гетеролитическую реакцию и ее скорость резко возрастает при переходе от неполярного к полярному растворителю. [6]
Если пероксиэфир А, в котором карбонильный атом кислорода мечен 180, подвергнуть серии превращений, показанных на схеме, то весь 180 будет обнаружен в бензиловом спирте. Перегруппировка А - v Б представляет собой гетеролитическую реакцию и ее скорость резко возрастает при переходе от неполярного к полярному растворителю. [7]
При термолизе пероксиэфиров в зависимости от строения происходит по одному из трех механизмов гомолиз одной или одновременно двух связей, пероксиэфир также может подвергаться перегруппировке. [8]
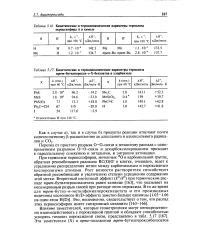 |
Кинетические и термодинамические параметры термолиза пероксиэфира А в кумоле.| Кинетические и термодинамические параметры термолиза mpew - бутилперокси-о - Х - бензоатов в хлорбензоле. [9] |
При термолизе пероксиэфиров, меченных 18О в карбонильной группе, обратная рекомбинация радикала RC ( O) O в клетке, очевидно, ведет к усреднению распределения метки между карбонильным и пероксидным кислородными атомами. Рост вязкости растворителя способствует обратной рекомбинации и увеличению степени усреднения содержания этой метки. Вторичный изотопный эффект ( А / Аг) при термическом распаде игре / и-бутилпероксиацетата равен единице [163], что указывает на несинхронный разрыв связей при распаде этого пероксида. [10]
При гидролизе пероксиэфиров легче образуются первоначальные кислоты и гидроперекиси, из которых они были получены, чем спирты и пероксикислоты. [11]
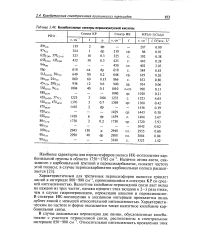 |
Колебательные спектры пероксиуксусной кислоты. [12] |
Характеристичным для третичных пероксиэфиров является триплет линий в интервале 800 - 900 смн, проявляющийся в спектрах КР со средней интенсивностью. Валентное колебание пероксидной связи дает вклад на каждой из трех частот, однако процент этих вкладов в 2 - 3 раза ниже, чем в случае гидропероксидов, пероксидов алкилов и пероксикислот. В спектрах ИК-поглощения в указанном интервале проявляется лишь дублет линий с меньшей относительной интенсивностью. Характеристическим по частоте и форме оказывается также валентное колебание карбонильной связи. [13]
Особенности пространственного строения пероксиэфиров показаны на рис. 2.22 и в табл. 2.12. Формально пероксиэфиры являются смешанными ацилалкилпероксидами. [15]
Страницы: 1 2 3 4