Пероксиэфир
Cтраница 4
Данные этой таблицы были получены по соотношению выходов пероксиэфиров при действии смесями соответствующих кислот. [46]
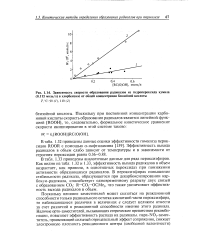 |
Зависимость скорости образования радикалов из гидропероксида кумила ( моль / л в хлорбензоле от общей концентрации бензойной кислоты. [47] |
В табл. 1.33 приведены аналогичные данные для ряда пероксиэфиров. Как видно из табл. 1.32 и 1.33, эффективность выхода радикалов в объем возрастает, как правило, в однотипных пероксидах при понижении активности образующихся радикалов. В пероксиэфирах повышение стабильности радикала, образующегося при декарбоксилировании кар-бокси-радикала, способствует одновременному разрыву двух связей с образованием СО2: R - СО2 - ОСМе3, что также увеличивает эффективность выхода радикалов в объем. [48]
Следовательно, оба колебания, как и в случае пероксиэфиров, существенно делокализованы. [49]
Положительный знак и величины реакционной константы щелочного гидролиза этих пероксиэфиров, близкие к значениям р для щелочного гидролиза сложных эфиров бензойной и алифатических кислот, указывают на слабое влияние второго пероксидного атома кислорода на реакционную способность - C ( O) - OOR - связи. Близкие и меньшие единицы значения изотопного эффекта при щелочном гидролизе подтверждают общность механизма сложных эфиров и пероксиэфиров. [50]
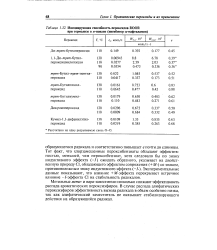 |
Инициирующая способность пероксидов ROOR. [51] |
Метальные мета - и ядра-заместители несколько снижают эффективность распада ароматических пероксиэфиров. В случае распада алифатических пероксиэфиров эффективность выхода радикала в объем особенно низка, так как алифатический заместитель не оказывает стабилизирующего действия на образующийся радикал. [52]
Таким образом, теоретическая оценка энергетики возможных каналов распада пероксиэфиров I и II убедительно свидетельствует о реализации простого гомолиза пероксидной связи при термическом разложении этих пероксидов. [53]
Зависимость константы скорости щелочного гидролиза от строения кислотной части ароматических пероксиэфиров описывается уравнением Гаммета lg ( Arx / & H) рах, где X - заместитель в бензольном цикле и р 2.28 ( см. гл. [54]
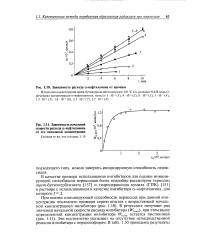 |
Зависимость расхода сс-нафтиламина от времени.| Зависимость начальной скорости расхода а-нафтиламина от его начальной концентрации. [55] |
Это постоянство указывает на отсутствие непосредственной реакции ингибитора с пероксиэфиром. [56]
Во многих случаях гетеролиз и гомо-лиз являются конкурирующими путями распада пероксиэфиров. Процесс гетеролиза ускоряется с ростом ионизирующей способности среды и при наличии кислотных или основных катализаторов. [57]
Гидролитическое расщепление и ресинтез пероксидной связи в процессах синтеза и гидролиза пероксиэфиров невозможны. В связи с этим исследуемую реакцию следует рассматривать как частный случай О-аци-лирования, в процессе которого от карбоксильной группы отщепляется гидроксйл, а от гидропероксидной - водород. [58]
Используется также для синтеза алкил-трет-бутил-пероксидов К-ОО-С ( СН3), и пероксиэфиров ( СН 3) 3 С-ОО-С ( О) К. [59]
Страницы: 1 2 3 4