Пероксиэфир
Cтраница 2
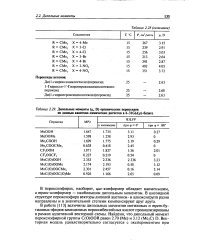 |
Дипольные моменты ( ц, D органических пероксидов. [16] |
В цисоидной структуре пероксиэфира векторы диполей ацетокси - и алкоксигрупп разно направлены и в значительной степени компенсируют друг друга. [17]
Простое термическое разложение пероксиэфиров приводит к енолу и бензойной кислоте. [18]
Так как из пероксиэфиров практически применяются только грет-бутилпероксиацетат и бензоат, описанный выше метод син теза аллиловых эфиров ограничивается получением ацетатов и бензоатов. [19]
Простое термическое разложение пероксиэфиров приводит к уенолу и бензойной кислоте. [20]
Так как из пероксиэфиров практически применяются только грет-бутилпероксиацетат и бензоат, описанный выше метод син теза аллиловых эфиров ограничивается получением ацетатов и бензоатов. [21]
Энергия активации перегруппировки пероксиэфира I с учетом термической поправки к полной энергии пероксиэфира и переходного состояния ( ZPE 228.6 кДж / моль) равна 122 8 кДж / моль. [22]
 |
Кинетические параметры щелочного гидролиза. [23] |
Обратная синтезу реакция гидролиза пероксиэфиров протекает с сохранением пероксидной связи как в кислой, так и в щелочной среде при невысоких температурах - до 40 - 50 С. [24]
 |
Кинетические параметры термолиза пероксиэфиров в растворителях. [25] |
Наряду с гемолизом для пероксиэфиров возможен и гетеролитичес-кий путь распада. [26]
Реакция применима также к пероксиэфирам RsCOOCOR, но используется реже. Если в молекуле присутствуют и алкильная, и арильная группы, то в основном мигрирует арильная. Получать и выделять гидропероксид необязательно. Реакция происходит при обработке спиртов HsO2 и кислотами. [27]
Сравнение скоростей распада диалкилпероксидов, пероксиэфиров и диацилпероксидов показывает, что наличие у а-углерода карбонильной группы облегчает разрыв О - О-связи благодаря сопряжению образующейся свободной валентности с карбонильной группой. Вообще, влияние заместителей на процесс термолиза весьма разнообразно. Введение в ацильную часть винильных, фенильных и алкильных заместителей вызывает резкое ускорение распада. Это связано не только с индукционным влиянием заместителей, но и с изменением механизма распада от разрыва одной О - О-связи к фрагментации с одновременным разрывом двух связей в результате ослабления R-C ( O) - cвязи уже в переходном состоянии и стабилизации радикала R вследствие мезомерного и гипер-конъюгационного влияния заместителей. [28]
Благодаря этому согласованному механизму распад соответствующих пероксиэфиров в растворе приводит к образованию карбоновой кислоты и альдегида или кетона. [29]
 |
Термолиз монопероксикеталей КМеС ( ОМе ООСМе3 в алкилароматических углеводородах. [30] |
Страницы: 1 2 3 4