Пероксокарбонат
Cтраница 1
Пероксокарбонаты являются мало исследованными соединениями. [1]
Пероксокарбонаты ( перкарбонаты), т.е. карбонаты, содержащие избыток кислорода, такие как ( NajCC) ( пероксомонокарбонаты) или ( Na2C2O6) ( пероксодикарбонаты); их получают действием диоксида углерода на пероксиды металлов. [2]
Пероксокарбонат натрия ( персоль) 2Na2CO3 ЗН2О2 - бесцветное малорастворимое кристаллическое вещество, поглощает влагу из воздуха. Разлагается при 140 С, образуя карбонат натрия и выделяя кислород, в водном растворе разлагается при 70 С. [3]
Пероксокарбонат натрия Na2 [ O2C - О - О - СО2 ] получают электролизом концентрированного раствора карбоната натрия. Эта реакция аналогична реакции, которая ведет к образованию пероксосульфата натрия ( стр. Надуголь-ная кислота, как и угольная, не существует в свободном состоянии. [4]
Гидролиз пероксокарбонатов натрия и калия сопровождается постепенным выделением активного кислорода и части углекислого газа. Последнее является специфическим свойством этих соединений, отличающим их от пероксигидратов карбонатов. По-видимому, в процессе гидролиза образуется неустойчивая надугольная кислота, которая при разложении и дает эффект выделения углекислого газа. [5]
При нагревании пероксокарбонаты разлагаются, в воде гидролизуются, а кислотами разрушаются. [6]
При нагревании пероксокарбонат натрия разлагается, выделяя кислород. [7]
Предельный ток пероксокарбоната, измеренный при - 0 6 в, линейно зависит от квадратного корня из высоты столба ртути ( y h), что подтверждает диффузионный характер волны. Концентрация пероксокарбоната, соответствующая данной высоте волны, рассчитывается по концентрации Н202, которая устанавливается в результате гидролиза пероксокарбоната. Концентрация Н202 определялась полярографически путем измерения высоты ее волны при - 1 4 в и сравнения со стандартными растворами. Высота суммарной волны пероксокарбоната и перекиси водорода ( измеряемая, например, при - 1 4 в) во время гидролиза пероксокарбоната почти не изменяется ( она лишь слегка возрастает), что указывает на близкие значения констант диффузионного тока обоих веществ. [8]
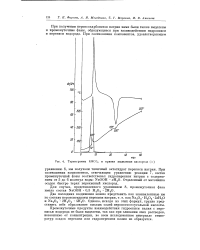 |
Термограмма КНСО и кривая выделения кислорода ( X. [9] |
При получении пероксокарбонатов натрия нами были также выделены и промежуточные фазы, образующиеся при взаимодействии гидроокиси и перекиси водорода. [10]
В растворе щелочи пероксокарбонаты значительно более стабильны, что, по-видимому, дает возможность следить за их реакциями при обычной температуре. [11]
В сухом состоянии электролитический пероксокарбонат довольно устойчив - в течение 2 лет он потерял всего лишь около 10 % активного кислорода. [12]
Разница между потенциалами пероксокарбоната и Н202 составляет 300 - 400 же, что служит основой для различения истинных пероксокарбонатов и пероксигидратов, которые специфического потенциала не имеют. [13]
Точному измерению концентрации пероксокарбоната мешает волна перекиси водорода. [14]
Существует два вида пероксокарбонатов: соли лероксокарбоновых кислот ( так называемые истинные перкарбонаты), к которым относятся N32 04, ШНС04, НазСзО, и сопьватированные соли типа Ма2СОз 1 ( 5Н202 Н20, образованные в результате присоединения пероксида водорода К карбонату натрия посредством водородной связи. [15]
Страницы: 1 2 3 4