Электронная плотность - связь
Cтраница 2
Таким образом, если в винилсиланах, в связи с электроноакцепторными свойствами триалкилсилильной группы, электронная плотность связи С С смещена к - углеродному атому, то в случае изопропснилтриметил-силана электронодонорные свойства метильной группы преодолевают противоположное влияние силильной группы, что и сказывается на порядке присоединения НХ. [16]
Понятно, что каждый атом или группа, содержащиеся в молекуле кислоты и снижающие в результате индукционного эффекта электронную плотность связи О - Н, тем самым уменьшают энергию, необходимую для отрыва протона молекулами воды. В этих условиях скорость реакции диссоциации увеличивается; иначе говоря, константа скорости k тем больше, чем больше способность группы X притягивать электроны. [17]
Сопоставляя относительные электроотрицательности элементов, образующих химическую связь, можно получить представление о том, в каком направлении происходит смещение электронной плотности связи между двумя атомами, а также относительную величину этого смещения. При этом следует, разумеется, иметь в виду, что сдвиг электронной плотности связи происходит в направлении атома элемента с более высокой электроотрицательностью. [18]
Таким образом, формула Кекуле не отражает полностью сложного строения бензола: она не отражает специфики ароматических связей, равенства электронной плотности связей, соединяющих атомы углерода; формула Кекуле совершенно не отражает данных электронографи-ческого исследования - о полной симметричности бензольного кольца с равными расстояниями между всеми атомами углерода. Тем не менее из всех предложенных формул она все же полнее отражает строение бензола, чем другие формулы. [19]
Сопоставляя относительные электроотрицательности элементов, образующих химическую связь, можно получить представление о том, в каком направлении происходит смещение электронной плотности связи между двумя атомами, а также относительную величину этого смещения. [20]
Сверхсопряжение проявляется в том - что атомы водорода радикала, связанного с ненасыщенной группой, являются активированными ( протонизированными): электронная плотность связей С - Н смещается в сторону двойной связи. [21]
Ясно, что для получения картины точного электронного распределения в молекуле илида необходимо знание длин связей, углов между ними и электронной плотности илидной связи. Проблема получения таких данных усложняется тем, что в молекуле илида, достаточно устойчивого для рентгенографического исследования, у илидного атома углерода должны находиться весьма большие группы. [22]
Сверхсопряжение ( пгаерконъюгация) проявляется в том, что атомы водорода радикала, связанного с ненасыщенной группой, являются активированными ( протонизированными): электронная плотность связей С - Н метильной группы смещается в сторону двойной связи. [23]
 |
Равномерное распределение электронных плотностей связей С - С. [24] |
Подводя итог всему сказанному, нужно отметить, что формула Кекуле не отражает полностью сложного строения бензола: она не отражает специфики ароматических связей, не отражает равенства электронных плотностей связей, соединяющих атомы углерода; формула Кекуле совершенно не отражает данных электронографического исследования - о полной симметричности бензольного кольца с равными расстояниями между всеми атомами углерода. Тем не менее из всех предложенных формул формула Кекуле все же полнее отражает строение бензола, чем другие формулы, и поэтому и до наших дней ею пользуются для обозначения бензола. [25]
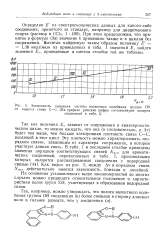 |
Зависимость смещения частоты валентного колебания группы ОН от индекса связи СС. ( На графике римские цифры соответствуют номерам. [26] |
Так как величина Е - зависит от сопряжения в квазиароматическом цикле, то можно ожидать, что она ( а следовательно, и Av) будет тем выше, чем больше электронная плотность связи СС, входящей в этот цикл. Эту плотность можно характеризовать порядком связи, зависящим от характера сопряжения, в котором участвует данная связь. Как видно из рис. 5, между Av и порядком связи Na Tl действительно имеется зависимость, близкая к линейной. [27]
Строение радикала R в ацильной части RCO - ОО - СО КГ очень слабо влияет на потенциал восстановления пе - роксидов ацилов, что, очевидно, является следствием слабой зависимости электронной плотности связи О - О пероксидов ацилов ( RC6H4CO - O) 2 от индукционного эффекта заместителей; это согласуется с низким значением реакционной константы р для корреляции констант скорости термического - распада пероксидов арилов и cf - констант заместителей. [28]
Согласно этим авторам, в состояниях IV и VI происходит меньшее отталкивание между электронами разрываемой связи ( например, Y - - С - X, где X - замещаемая группа) и электронами связей С - R, чем в состояниях V и VII, поскольку поверхность минимума электронной плотности связи Y - - С - X в первом случае находится в лучшем соответствии с положениями групп R. Джилле-спи ( Gillespie, 1952) произвел вычисления, относящиеся к двум: возможным типам конфигураций, применяя приближение, заключающееся в том, что d - орбиты углерода вносят свою долю в величину связывающих сил в этих переходных состояниях; на основании этих вычислений представляется правдоподобным, что. [29]
Присоединение по двойной углерод-углеродной связи протекает как результат электрофильной атаки - я-электронного облака молекулы. Повышение электронной плотности связи ускоряет, а снижение затрудняет протекание реакции. [30]
Страницы: 1 2 3 4