Поведение - растворенное вещество
Cтраница 4
Развитые до настоящего времени теории кислот и оснований позволили многое понять в свойствах растворителей и растворов. Однако еще не создана всеобъемлющая теория растворителей, которая на основе единой концепции строения системы растворитель - растворенное вещество могла бы количественно описать все ее важнейшие свойства. В то же время для различных классов растворителей разработаны теории, которые могут качественно объяснить и предсказать результат влияния природы растворителя на процесс растворения и поведение растворенного вещества в различных реакциях. Среди этих теорий можно назвать теорию сольвосистем, которая разработана для ионизирующихся растворителей, координационную теорию, рассматривающую по большей части растворители с донорно-акцепторными свойствами, протонную теорию, пригодную для растворителей, в которых происходит перенос протонов. [46]
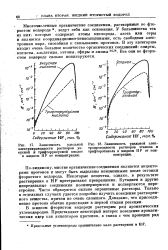 |
Зависимость удельной электропроводности растворов этанола и трифторэтанола в жидком HF от концентрации. [47] |
По-видимому, многие органические соединения являются акцепторами протонов и могут быть выделены неизменными после отгонки фтористого водорода. Некоторые вещества, однако, в результате растворения в HF претерпевают превращения. Бутадиен и другие непредельные соединения полимеризуются и подвергаются перестройке. Часто образуются сильно окрашенные растворы. Только в отдельных случаях удается подробно изучить поведение растворенного вещества, причем не очень сложного. Доказано, что присоединение протона обычно происходит в первой стадии реакции. [48]
В химическом анализе широко используют как водные, так и органические растворители. Неполярные растворители, такие, как углеводороды и их галогенпроизводные, применяются в том случае, если само анализируемое вещество неполярно. Органические растворители с промежуточной полярностью, способные образовывать водородные связи с растворенным веществом ( спирты, кето-ны и эфиры), употребляются значительно чаще, чем менее полярные соединения, так как в них растворимо большое число органических и неорганических веществ. Наиболее широко в аналитической практике используют, пожалуй, водные растворы, в том числе растворы неорганических кислот и оснований. Поэтому в нашем изложении основное внимание уделяется поведению растворенных веществ в воде; реакции в неводных полярных средах будут рассматриваться менее подробно. [49]
Недавно [15] сообщили об исследовании образования металлопорфиринов в микроэмульсии м / в. Микроэмупьсии обладают рядом уникальных свойств, которых нет у мицелл, монослоев или полиэлектролитов. Водные мицеллы могут вбирать в себя одну или несколько молекул растворенного вещества. Так как микрокапля мицеллярной эмульсии обладает большей поверхностью и большим внутренним объемом переменной полярности, то она может вобрать в себя существенно больше молекул растворяемого вещества. Эмульсии с большими размерами капель в этом отношении близки к мик-роэмупьсиям, но у них меньше поверхностный заряд, они полидис-сперсны, нестабильны и непрозрачны. Работа по исследованию включения иона металла [15] показала, что очень существенным моментом для понимания механизма взаимодействия ионов с поверхностью является выяснение характера распределения ионных и нейтральных соединений между фазами. В этой работе представлены результаты исследования поведения растворенных веществ в микроэмульсиях м / в, а также свойств таких систем. [50]
Сп - концентрация растворенного вещества в точке пересечения хорды равновесия с прямой, проведенной из вершины растворенного вещества через критическую точку. Межфазное натяжение можно также представить графически как функцию концентрации растворенного вещества в состоянии равновесия. Эти системы проявляют свойства, характерные для всех других подобных систем. Наивысшим межфазным натяжением обладает система без растворенного вещества ( точка 1), в критической точке натяжение уменьшается до нуля. Линии, соединяющие точку / с точкой К, представляют концентрации уксусной кислоты в водной фазе и фазе растворителя. Состояние равновесия и соответствующее ему поверхностное натяжение отыскиваются на горизонтальных прямых. Линии концентраций пересекаются, если хорды равновесия на треугольной диаграмме меняют наклон. При небольших наклонах хорд линии концентраций лежат близко друг к другу, при больших-расходятся. Так как вблизи критической точки межфазное натяжение приближается к нулю, при больших концентрациях растворенного вещества система приобретает тенденцию к устойчивому эмульгированию. По форме кривых можно сделать выводы относительно поведения растворенного вещества в обеих фазах. [51]
Страницы: 1 2 3 4