Поверхность - алюмосиликат
Cтраница 4
Например, поверхности оксидов в момент образования проявляют более высокую химическую активность, чем после выдерживания их на воздухе и тем более при высоких температурах. Значительное влияние на свойства поверхности оксидов оказывает предварительное взаимодействие с парами воды, например, на поверхности алюмосиликатов изменяется количественное соотношение между бренстедовскими и льюисовскими кислотными центрами. [46]
Существование вторичных частицу случае Са -, Ni - и А1 - форм монтмориллонита значительно осложняет диффузию ионов бутиламмония к ионообменным центрам этого минерала. В случае же натриевой формы равновесие обмена определяется только скоростью диффузии органического катиона и не осложнено стерическими затруднениями. Кроме этого фактора на кинетику обмена оказывает влияние, по-видимому, энергия связи изученных катионов с поверхностью алюмосиликата. Согласно теории двойного электрического слоя, гидратированные ионы натрия связаны слабыми электростатическими силами с поверхность адсорбента и образуют в основном диффузный слой противоионов. Скорость обмена в этом случае определяется только скоростью взаимодиффузии через пленку жидкости ионов натрия и бутиламмония. [47]
 |
Зависимость кажущейся константы. [48] |
Полученные результаты позволяют сделать такие основные выводы. Для описания статического равновесия в системе солевая форма глинистого минерала - короткоцепочечный алкиламмониевый катион формально можно использовать уравнение изотермы адсорбции Ленгмюра. Однако вычисленные из этого уравнения константы Ь количественно характеризуют только среднюю величину адсорбируемое изученного органического катиона на поверхности алюмосиликата. Это вызвано тем, что реальная поверхность глинистых частиц является энергетически неоднородной. [49]
В противоположность окиси алюминия, алюмосиликат очень мало активен в реакции обмена водорода с дейтерием в смеси к-пропана и дейтерия. Наиболее активен образец смешанного окисла, дегидратированный при 52 5 С, на котором концентрация легкого углеводорода уменьшается меньше, чем на 3 % за 50 мин при 400 С. Возможно, важным, но не решающим фактором, определяющим скорость обмена на алюмосиликате, является низкая адсорбция пропана на поверхности алюмосиликата при такой высокой температуре. Пропан не адсорбируется при 400 С на алюмосиликате, дегидратированном при 505 С, тогда как активированные в тех же условиях образцы катализатора адсорбировали 6 74 мл ( НТ. Для смешанного окисла М имеет значение 0 93 - 1 1, и энергия активации обмена равна - 16 ккал / молъ. [51]
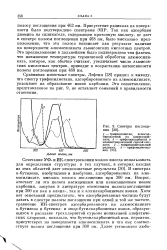 |
Спектры поглощения. [52] |
В спектрах w - бутилена, изобутилена и изобутана, адсорбированных на алюмосиликате, имелась полоса поглощения при 300 нм. Вопрос, отвечает ли эта полоса насыщенным или ненасыщенным ионам карбония, запутан в литературе отнесением полосы поглощения при 300 нм как к алкил -, так и к аллилкарбониевым ионам. Хотя нет оснований предполагать, что адсорбированные частицы будут давать в спектре полосы поглощения при одной и той же частоте, сравнение ИК-спектров адсорбированного на алюмосиликате к-бутилена и бутенил - и emop - бутилкарбониевых ионов, образующихся в расплаве треххлористой сурьмы ионизацией алифатических хлоридов, показало, что бутенилкарбониевый ион, вероятно, присутствует на поверхности алюмосиликата и что ему соответствует полоса поглощения при 300 нм. [53]
В биохимии хорошо известно, что субстрат повышает устойчивость ферментной системы. Оставаясь в пределах гипотез, можно схематически представить себе ряд последовательных динамических структур возрастающей сложности, в развитии которых принимают участие катализаторы. Практически процессы полимеризации на поверхности алюмосиликатов могли бы служить объектом, который мы таким образом моделируем. Продукт реакции гидролизуется, и поэтому в целом можно рассматривать реакцию как средство для поддержания динамической структуры, обозначенной на схеме ( 1) Xi, Ха, Х3, Х4 ( см. стр. [54]
Таким образом, метиловый спирт при адсорбции вытесняет воду с поверхности алюмосиликата, что также подтверждает протекание указанной реакции на поверхности исследованных катализаторов. [55]
Страницы: 1 2 3 4