Поверхность - силикагель
Cтраница 1
Поверхность силикагеля, найденная по формуле s amNА для уксусной и лауриновой кислот, равна 300 м2 / г, что соответствует реальной величине удельной поверхности силикагеля и указывает на правильность значений индивидуальных емкостей монослоев. [1]
 |
Природа поверхности двуокиси кремния. [2] |
Поверхность силикагеля обладает слабыми кислотными свойствами ( рН 3 - 5), и, как следствие, соединения основного характера ( РК g 5) адсорбируются на ней лучше, чем на нейтральных или основных адсорбентах. Иногда поверхность силикагеля бывает сильно кислой. Наблюдается это в тех случаях, когда она загрязнена кислотами, использованными лри получении геля. Такие силикагели следует очистить повторным промыванием дистиллированной водой, иначе возможна хемосорбция оснований или взаимодействие с растворенными веществами, чувствительными к кислотам. [3]
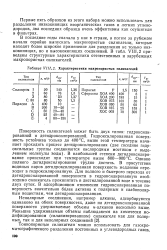 |
Характеристики макропористых силикагелей. [4] |
Поверхность силикагелей может быть двух типов: гидроксили-рованной и дегидроксилированной. В наибольшей степени дегидроксилиро-вание происходит при температуре выше 800 - 900 С. Однако полного дегидроксилирования трудно достичь. В присутствии водяных паров дегидроксилированная поверхность медленно переходит в гидроксилированную. Для полного и быстрого перехода от дегидроксилированной поверхности в гидроксилированную необходимо силикагель прокипятить в дистиллированной воде в течение двух суток. В адсорбционном отношении гидроксилированная поверхность значительно более активна к полярным и слабополярным веществам, чем дегидроксилированная. [5]
Поверхность силикагелей в химическом отношении неоднородна и адсорбционные свойства в сильной степени зависят от содержания и нем плаги. [6]
Поверхность силикагеля и аэросила SiO2 образована силанольными группами ( SiOH) и адсорбированной водой. [7]
Поверхность силикагеля покрыта гидроксильными группами, связанными с атомами кремния кремнекиелородного остова. Вследствие того что электронная d - оболочка атома кремния не заполнена, распределение электронной плотности в гидроксильных группах поверхности кремнезема таково, что отрицательный заряд сильно смещен к атому кислорода, так что образуется диполь с центром положительного заряда у атома водорода, размеры которого невелики. Часто молекулы адсорбата, обладающие резко смещенной к периферии электронной плотностью ( например, неподеленные электронные пары атома кислорода в молекулах воды спиртов или эфиров), образуют дополнительно к рассмотренным выше взаимодействиям водородные связи с этими гидроксильными группами поверхности. [8]
Поверхность силикагеля покрыта гидроксильными группами, связанными с атомами кремния кремнекислородного остова. Вследствие того что электронная d - оболочка атома кремния не заполнена, распределение электронной плотности в гидроксильных группах поверхности кремнезема таково, что отрицательный заряд сильно смещен к атому кислорода, так что образуется диполь с центром положительного заряда у атома водорода, размеры которого невелики. Часто молекулы адсорбата, обладающие резка смещенной к периферии электронной плотностью ( например, неподеленные электронные пары атома кислорода в молекулах воды, спиртов или эфиров), образуют дополнительно к рассмотренным выше взаимодействиям водородные связи с этими гидроксильными группами поверхности. [9]
Поверхность силикагеля сильно катализирует реакцию неполного окисления метана, однако выход формальдегида из-за протекания побочных реакций невысокий. [10]
Поверхность силикагеля и аэросила SiO2 образована силанольными группами ( SiOH) и адсорбированной водой. [11]
На поверхности силикагеля, несомненно, имеется много гидроксильных групп ( [1836] и приводимые в этой работе ссылки, а также [2017]); это же справедливо и для гелей других окислов, если они не подвергались слишком жесткой тренировке. В этом отношении наиболее важную роль сыграли, по-видимому, исследования ИК-спектров, которые позволили частично идентифицировать типы адсорбированных на SiOg молекул. [12]
ОН-груп-пами поверхности силикагеля; S - поверхность образца силикагеля ( см2); р - число обменоспособных гидроксильных групп ( см-2); к2 - константа, представляющая собой произведение мощности дозы на константу скорости обратной реакции - обмена водорода с OD-группами силикагеля; п0 и п - начальное и текущее количество атомов дейтерия в газовой фазе. [13]
На поверхности силикагеля внедрены ( например, с помощью химической реакции) молекулы органических соединений. [14]
Поскольку Поверхность силикагеля надежно защищена гидрофобным слоем длинноцепочечных алкилсиланов, влияние остаточных силанольных групп на молекулы образца обусловлено только дальнодействующими электростатическими взаимодействиями. Следовательно, наличие силанольных групп проявляется сильнее при высоких значениях рН ( более 5), когда эти группы становятся отрицательно заряженными, а также при разделении образцов основной природы, которые при таких значениях рН могут нести положительный заряд. Молекулы полиэлектролитов ( см. ниже) также склонны взаимодействовать с поверхностными зарядами, поскольку они достаточно велики, чтобы испытывать влияние электростатических сил со стороны сразу нескольких ионизированных силанольных групп. [15]
Страницы: 1 2 3 4