Поверхность - пористое стекло
Cтраница 3
Эти результаты объясняются реакцией с участием атомов бора, находящихся на поверхности пористого стекла. [31]
В работе [19] в спектре молекул воды, адсорбированных пористым стеклом после откачки при 800 С, установлено при малых заполнениях существование трех полос поглощения с максимумами 3665, 3645 и 3600 см-1. Предполагается, что эти полосы поглощения соответствуют молекулам, взаимодействующим с различными центрами поверхности пористого стекла. [32]
 |
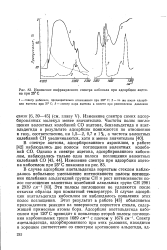
Изменение спектра валентных колебаний гидроксильных групп пористого стекла в обертонной области при термической обработке. [33] |
Ярославский [47, 66] исследовал изменение полосы поглощения первого обертона валентных колебаний гидроксильных групп пористого стекла при постепенном повышении температуры прокаливания образца от 100 до 1000 С. В соответствии с данными табл. 4 это уменьшение интенсивности указывает на постепенное дегидроксилирование поверхности пористого стекла. [34]
Полоса поглощения групп ВОН обычно не наблюдается в спектре после обработки пористого стекла при температурах ниже 600 С. Однако авторы работы [68] считают, что спектральное исследование адсорбции NH3 указывает на наличие на поверхности пористого стекла, обработанного при не слишком высоких температурах, сравнительно большого количества атомов бора. Концентрация примесных атомов бора на поверхности пористого стекла значительно повышается после прокаливания при температурах выше 600 С, когда начинается диффузия атомов бора из объема на поверхность. Следует подчеркнуть, что адсорбционные свойства поверхности кремнеземов, содержащих примесные атомы, изменяются не только в результате появления новых адсорбционных центров, но также и в результате влияния их на свойства соседних силанольных групп поверхности. [35]
В работе Сидорова [5], проведенной на тонких пластинках из пористого стекла, было уже отмечено уменьшение интенсивности полосы поглощения свободных гидроксильных групп поверхности кремнезема, но только при больших относительных давлениях пара воды. На этом основании Сидоров сделал заключение о том, что гидроксильные группы поверхности кремнезема являются центрами адсорбции только при больших заполнениях поверхности пористого стекла, а при меньших заполнениях адсорбция воды происходит на центрах второго рода. [36]
Однако в пористых стеклах, получаемых из щелочноборосиликатных стекол, всегда содержится примесь В203, и, как это было отмечено в [1], активными центрами на поверхности пористых стекол могли быть координационно ненасыщенные атомы бора. [37]
Однако в пористых стеклах, получаемых из щелочноборосиликатных стекол, всегда содержится примесь В90Я, и, как это было отмечено в [1], активными центрами на поверхности пористых стекол могли быть координационно ненасыщенные атомы бора. [38]
Остающаяся полоса ( 2990 см 1) соответствует молекулам хлороформа, адсорбированным на центрах второго рода. Интенсивность этой полосы зависит от температуры вакуумной тренировки образца, предшествующей адсорбции хлороформа: в спектре образца, прокаленного при 720 С, она в несколько раз выше, чем в спектре образца, прокаленного при 300 С, несмотря на некоторое сокращение поверхности пористого стекла после прокаливания до 720 С. [39]
Полоса поглощения групп ВОН обычно не наблюдается в спектре после обработки пористого стекла при температурах ниже 600 С. Однако авторы работы [68] считают, что спектральное исследование адсорбции NH3 указывает на наличие на поверхности пористого стекла, обработанного при не слишком высоких температурах, сравнительно большого количества атомов бора. Концентрация примесных атомов бора на поверхности пористого стекла значительно повышается после прокаливания при температурах выше 600 С, когда начинается диффузия атомов бора из объема на поверхность. Следует подчеркнуть, что адсорбционные свойства поверхности кремнеземов, содержащих примесные атомы, изменяются не только в результате появления новых адсорбционных центров, но также и в результате влияния их на свойства соседних силанольных групп поверхности. [40]
Однако не вызывает сомнения, что центрами второго рода не могут быть ультрамикропоры или загрязнения поверхности примесями, так как в противном случае трудно было бы объяснить зависимость количества этих центров от температуры предварительной вакуумной тренировки, которая обнаруживается в случае адсорбции хлороформа. Из общепринятых представлений о структуре поверхности пористого стекла следует предположить, что центрами второго рода могут быть атомы кремния или кислорода. Представляется маловероятным, что молекула аммиака, имеющая электроотрицательный атом азота, может присоединяться к электроотрицательному атому кислорода поверхности адсорбента. Более вероятно, что центрами адсорбции для молекулы аммиака служат поверхностные координационно ненасыщенные атомы кремния. Впрочем, вполне возможно, что при адсорбции различных соединений в качестве центров адсорбции второго рода выступают различные молекулярные группы поверхности силикатного адсорбента. [41]
Для ненанесенных образцов величину поверхности обычно определяют путем исследования физической адсорбции. Однако этот метод неприменим для нанесенных катализаторов, так как он дает величину площади полной поверхности, а не площади поверхности только нанесенного вещества. В табл. 2 приведены результаты определения величины поверхности пористых стекол, содержащих окись никеля ( П), методом БЭТ. [42]
 |
Изменение инфракрасного спектра кабосила при адсорбции ацетона при 25 С. [43] |
Эти полосы поглощения не удаляются после откачки образца при комнатной температуре. Этот результат в работе [43] объясняется прохождением реакции на поверхности пористого стекла, содержащей примесные атомы бора. [44]
 |
Схематическое изображение В5 - центра и ориентация диполя, индуцированного в молекуле азота. [45] |
Страницы: 1 2 3 4