Поверхность - ртутный электрод
Cтраница 2
Значительные величины перенапряжения наблюдаются при осаждении из водных растворов на поверхности ртутного электрода металлов группы железа. Перенапряжение при этом является приближенно линейной функцией от логарифма плотности тока: т а Ъ Igi. Вероятно, что относительно высокое перенапряжение, наблюдаемое для этих металлов, связано с замедленностью стадии разряда ионов. [16]
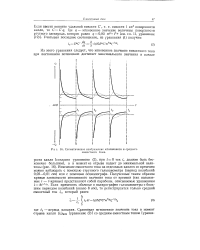 |
Схематическое изображение мгновенного и среднего емкостного тока. [17] |
C C q, где q - мгновенное значение величины поверхности ртутного электрода, которое равно q 0 85 / п2 / з Лз [ см. гл. [18]
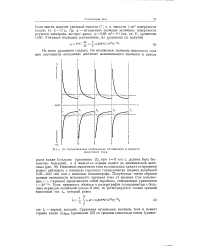 |
Схематическое изображение мгновенного и среднего емкостного тока. [19] |
C C q, где q - мгновенное значение величины поверхности ртутного электрода, которое равно 9 0 85 / п2 / з / 2 / з [ см. гл. [20]
Нужно заметить, что вследствие преимущественной ориентировки группы ОН - к поверхности ртутного электрода между обеими частицами должны наблюдаться большие силы положительного аттракционного взаимодействия. Образующийся смешанный адсорбционный слой должен быть значительно более прочным и плотным. [21]
Полярографический метод дает воспроизводимые результаты только в том случае, если поверхность ртутного электрода постоянно возобновляется. Это требование полностью удовлетворяется применением капельного электрода. Следующим условием получения хороших результатов является постоянная продолжительность образования и падения ртутных капель. В чистых водах это требование легки выполнимо, но в сильно загрязненных водах продолжительность образования капель меняется, причем вместе с ней меняется и измеряемый ток. Недостатком метода является значительный расход ртути, но последний может быть значительно снижен при периодической регистрации содержания кислорода в воде. Промежутки между измерениями можно установить заранее. Когда измерения не производятся, отверстие для вытекания ртути из резервуара должно быть закрыто. [22]
Значительно более отчетливо указанный деполяризующий эффект, обусловленный присутствием смолы на поверхности ртутного электрода, был выражен при исследовании электроноионообменников, окислительно-восстановительная функция которых определяется присутствием в смоле ионов металлов переменной валентности. Примером служит рис. 4, в верхней части которого помещены тафелевские прямые для чистой ртути и ртутного электрода с навеской окисленной смолы ЭЙ-12 0 05 г. Деполяризующий эффект, обусловленный наличием смолы на поверхности ртути даже при самых малых плотностях тока, составлял в данном случае около 0 7 в и еще более увеличивался с возрастанием плотности поляризующего тока. В нижней части рисунка показан аналогичный график для смолы ЭЙ-15, из которого следует, что деполяризация реакции катодного выделения водорода на ртути в присутствии навески ЭИ-15 выражена также крайне резко. [23]
В настоящее время имеется определенная информация о поведении ферментов и белков на поверхности ртутного электрода. При адсорбции на поверхности ртути происходят существенные конформационные изменения белков. Возникающая структура содержит большое число пор, допускающих диффузию низкомолекулярных реагентов к поверхности электрода. [24]
Вследствие высокого перенапряжения водорода на ртути ионы Н заметно не восстанавливаются ионами Сг2 на поверхности ртутного электрода, который таким образом измеряет истинный потенциал раствора. [25]
При катодной поляризации ртутного электрода в растворе хлористого натрия в начале поляризации хлор десорбируется с поверхности ртутного электрода. [26]
При катодной поляризации ртутного электрода в растворе хлорида натрия в начале поляризации хлор десорбируется с поверхности ртутного электрода, при этом поверхностное натяжение ртути повышается. Рост поверхностного натяжения наблюдается до потенциала нулевого заряда. В точке нулевого заряда емкость электрода минимальна в разбавленных растворах, но хлор еще остается. При дальнейшей катодной поляризации наряду с продолжающейся десорбцией хлора происходит адсорбция водорода и затем натрия. Поверхностное натяжение ртути при этом понижается. [27]
Однако в полярографии большая часть остаточного тока возникает вследствие заряжения так называемого двойного электрического слоя у поверхности ртутного электрода; поверхность раздела фаз ртуть - раствор ведет себя как очень маленький конденсатор. Для того чтобы ртуть приобрела потенциал, соответствующий внешнему наложенному напряжению, электроны движутся к поверхности ртути или от нее в зависимости от устанавливаемого потенциала и от состава раствора. Поскольку каждая капля ртути, вытекающая из отверстия капилляра, заряжается до соответствующего потенциала, возникает непрерывный ток. [28]
Для изучения электрохимических свойств простых радикалов COJ и СНз был применен фотоэлектрохимический эффект [15], Облучение поверхности ртутного электрода приводит к фотоэмиссии электроноввраствор которые могут реагировать с соответствующим перехватчиком. В результате этого происходит гомогенное генерирование радикалов. Этот метод является более предпочтительным по сравнению с методом импульсного радиолиза. [29]
Допустимый уровень загрязнения при кинетических исследованиях может быть значительно более высоким в случае полярографических методов, где поверхность ртутного электрода постоянно обновляется, а также в тех случаях, когда отношение объема раствора к поверхности электрода мало, как, например, в тонкослойных методах. Оба эти случая описаны ниже. [30]
Страницы: 1 2 3 4