Поверхность - капельный электрод
Cтраница 2
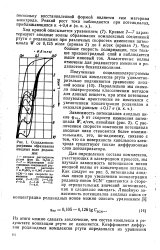 |
Осциллополярограммы образования анодных волн роданидов. [16] |
С увеличением скорости изменения потенциала анодные пики становятся более положительными, это, по-видимому, связано с тем, что на поверхности капельного электрода существуют тонкие диффузионные слои деполяризатора. [17]
Однако, как недавно показал Ванг [4], даже в присутствии сульфатов и нитратов при больших анодных токах достигается предельный ток, соответствующий образованию пересыщенного раствора соответствующей соли у поверхности капельного электрода. [18]
Двойной электрический слой у поверхности электрода оказывает существенное влияние на скорость электрохимических процессов, а в случае ртутного капельного электрода - также на величину емкостного тока ( тока заряжения), обусловленного периодическим изменением поверхности капельного электрода. Поэтому правильная интерпретация многих данных, полученных полярографическим методом, невозможна без учета влияния строения двойного электрического слоя на границе электрод электролит. [19]
Это уравнение, согласно которому время &, соответствующее полному покрытию поверхности электрода, обратно пропорционально квадрату концентрации поверхностноактивного вещества в растворе СА, является одновременно критерием, с помощью которого можно решить, какой из процессов определяет количество вещества, адсорбированного на поверхности капельного электрода. [20]
Это уравнение, согласно которому время ft, соответствующее полному покрытию поверхности электрода, обратно пропорционально квадрату концентрации поверхностноактивного вещества в растворе СА, является одновременно критерием, с помощью которого можно решить, какой из процессов определяет количество вещества, адсорбированного на поверхности капельного электрода. [21]
Каталитическое выделение водорода в растворах органических катализаторов, включающее в себя как предшествующую реакцию протонизации, так и последующую бимолекулярную реакцию, является одним из наиболее сложных электрохимических процессов; однако, благодаря тому что при каталитических процессах происходит быстрая и полная регенерация катализатора у поверхности капельного электрода, вывод уравнений для каталитических токов и объяснение влияния различных факторов на них оказываются значительно проще, чем в случае кинетических волн. Именно поэтому ряд явлений, описанных в IV, V, VI и VIII главах, в частности влияние адсорбции деполяризатора на электродные процессы, были впервые детально изучены на примере каталитических волн водорода. [22]
Зависимость тока от потенциала в этом случае также имеет форму волны, а поэтому уравнение (4.50) называют уравнением необратимой полярографической волны. В условиях нестационарной диффузии к поверхности капельного электрода это уравнение является приближенным, но по ряду признаков можно отличить необратимую волну от обратимой. [23]
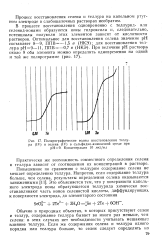 |
Полярографические волны восстановления теллура ( IV и селена ( IV в сульфидно-аммиачной среде при рН - 9. Концентрация 10 мкг / мл. [24] |
Повышенное по сравнению с теллуром содержание селена не мешает определению теллура. Это объясняется тем, что у поверхности капельного электрода ионы образующегося теллурида химически восстанавливают часть ионов селенистой кислоты, диффундирующих. [25]
Ток заряжения на ртутном капельном электроде обусловлен потреблением электричества на заряжение двойного электрического слоя вновь образующейся поверхности раздела ртуть - раствор. Таким образом, ток заряжения зависит от скорости образования поверхности капельного электрода и плотности зарядов 8 при данном потенциале электрода. [26]
Ток заряжения на ртутном капельном электроде обусловлен потреблением электричества на заряжение двойного электрического слоя вновь образующейся поверхности раздела ртуть - раствор. Таким образом, ток заряжения зависит от скорости образования поверхности капельного электрода и плотности зарядов s при данном потенциале электрода. [27]
В заключении раздела, посвященного этому методу, следует указать на задачи, остающиеся открытыми при точном решении явлений переноса в случае электролиза на капельном электроде: гидродинамические проблемы мы оставляем без внимания. Прежде всего это определение полярографических токов в том случае, если какое-либо из участвующих веществ адсорбируется на поверхности капельного электрода. Вторая проблема, хотя и формальна, но крайне важна именно для решения задачи об адсорбционных токах, где она занимает, вероятно, главенствующее положение, это проблема асимптотического приближения. [28]
От указанных недостатков почти свободен так называемый точный метод решения деполяризационных задач для электродных процессов с химическими реакциями, разработанный Я. Метод Коутецкого основан на решении системы дифференциальных уравнений в частных производных, описывающих подачу вещества в результате диффузии с учетом движения поверхности растущего капельного электрода, а также учитывающих образование ( или потребление) веществ вследствие протекания химических реакций в приэлектродном слое. Метод Коутецкого применим как к быстрым, так и к сравнительно медленным процессам; он позволяет получить выражение для потока деполяризатора к электродной поверхности, а следовательно, и для величины тока-в виде функции времени и параметров, характеризующих диффузию и химическую реакцию. [29]
От указанных недостатков почти свободен так называемый точный метод решения деполяризационных задач для электродных процессов с химическими реакциями, разработанный Я. Метод Коутецкого основан на решении системы дифференциальных уравнений в частных производных, описывающих подачу вещества в результате диффузии с учетом движения поверхности растущего капельного электрода, а также учитывающих образование ( или потребление) веществ вследствие протекания химических реакций в приэлектродном слое. Метод Коутецкого применим как к быстрым, так и к сравнительно медленным процессам; он позволяет получить выражение для потока деполяризатора к электродной поверхности, а следовательно, и для величины тока в виде функции времени и параметров, характеризующих диффузию и химическую реакцию. [30]
Страницы: 1 2 3 4