Корродирующая поверхность - металл
Cтраница 1
Корродирующая поверхность металла является короткозамк-нутым многоэлектродным гальваническим элементом. Материальный эффект электрохимического разрушения ( растворения) сосредоточен на анодных участках корродирующего металла. Анодное растворение металла возможно при одновременном протекании катодного процесса - ассимиляции освободившихся электронов на катодных участках металла. Согласно классической теории электрохимической коррозии, участки анодной и катодной реакции пространственно разделены, и для протекания процесса коррозии необходим переток электронов в металле и ионов в электролите. Однако пространственное разделение анодной и катодной реакции оказывается энергетически более выгодным, так как анодные и катодные реакции могут локализоваться на тех участках, где их протекание более облегчено. Поэтому в большинстве практических случаев протекание электрохимической коррозии обычно характеризуется локализацией анодного и катодного процессов на различных участках корродирующей поверхности металла. [1]
Корродирующая поверхность металла является, таким образом, короткозамкнутым сложным микрогальваническим элементом, материальный эффект работы которого реализуется в виде растворения металла на его анодных участках. [2]
 |
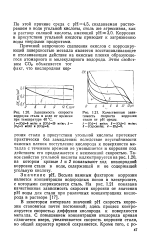
Зависимость скорости коррозии стали от плотности воды ( Туймазинское месторождение.| Влияние концентрации взвешенных частиц на скорость коррозии стали. [3] |
В этих условиях корродирующая поверхность металла возрастает, а скорость коррозии увеличивается. [4]
Под влиянием этих факторов корродирующая поверхность металла становится многоэлектродным гальваническим элементом. [5]
 |
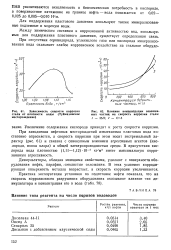
Схема установки для проведения коррозионных испытаний.| Сх ма установки для измерения микротоков на корродирующей поверхности металла. [6] |
Для обнаружения токов на корродирующей поверхности металла отводящими ток электродами служат два насыщенных каломельных электрода ( см. рис. 11, б), снабженные подвижными наполненными водным раствором КС1 и агар-агара стеклянными трубками с капиллярными отверстиями на концах. [7]
Токи, возникающие на корродирующей поверхности металла, обнаруживают путем их отвода каломельными электродами. К электродам резиновым шлангом присоединены стеклянные трубки с капиллярными отверстиями на концах. Стеклянные трубки наполнены водным раствором К. [8]
Причина непрочного сцепления оксидов с корродирующей поверхностью металла - восстанавли вающее - и отслаивающее действие на оксидные пленки образующегося атомарного и молекулярного водорода. [9]
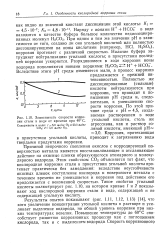 |
Зависимость скорости коррозии стали в воде от времени при 40 С. [10] |
Причиной непрочного сцепления окислов с корродирующей поверхностью металла является восстанавливающее и отслаивающее действие на окисные пленки образующегося атомарного и молекулярного водорода. Этим свойством СО2 объясняется тот факт, что кислородная коррозия стали в присутствии угольной кислоты протекает практически без замедления: вследствие неустойчивости окисных пленок поступление кислорода к поверхности металла с течением времени не уменьшается и коррозия под действием его продолжается с неизменной скоростью. Такое свойство угольной кислоты иллюстрирует рис. 1.10, на котором кривые / и 2 показывают ход кислородной коррозии стали в воде, содержащей и не содержащей угольную кислоту. [11]
Причиной непрочного сцепления окислов с корродирующей поверхностью металла является восстанавливающее и отслаивающее действие на окисные пленки образующегося атомарного и молекулярного водорода. [13]
Цель работы - обнаружить гальванические элементы на корродирующей поверхности металла отводом с нее микротоков, определить направления и величины этих токов, вызванных различными причинами, и исследовать влияние электрохимической гетерогенности поверхности на коррозионную стойкость металла. [14]
Действие анодных ингибиторов основано на пассивации анодных участков корродирующей поверхности металла. Поэтому их нередко называют пассиваторами. [15]
Страницы: 1 2 3 4 5