Корродирующая поверхность - металл
Cтраница 3
В - зона диффузионного переноса кислорода через конденсационный ( или адсорбционный) слой влаги или продуктов коррозии непосредственно на корродирующей поверхности металла. При сильной влагонаполненности почвы или, наоборот, в очень сухих почвах граница между слоями Б и В может отсутствовать. [31]
Однако после точки 1 сопротивление продолжает убывать ( участок кривой /, 6, 2f), что объясняется особенностью микроструктуры корродирующей поверхности металла, обладающей множеством выступов и впадин. Выступы и впадины представляют как бы совокупность микроскопических ( капиллярных) сосудов разных диаметров и высот. [32]
В большинстве практических случаев протекание электрохимической коррозии обычно характеризуется локализацией анодного и катодного процессов на различных ( более или менее постоянных) участках корродирующей поверхности металла, что приводит к неравномерному или местному характеру ( см. с. [33]
С увеличением площади катодных участков на поверхности корродирующего металла возрастает ток коррозии и снижается перенапряжение водорода, поэтому скорость коррозии металла будет увеличиваться до тех пор, пока на корродирующей поверхности металла не возникнет плотный слой вторичных продуктов коррозии, препятствующий соприкосновению металла со средой. [34]
При выпадении из раствора, не содержащего сероводород, гидроокиси железа изменение потенциала во времени замедляется и продолжает затем лишь медленно сдвигаться в отрицательную сторону, что связано с процессом активации корродирующей поверхности металла, а также медленным повышением рН среды. [35]
Развитие теории защитного действия ингибиторов идет сейчас в направлении объединения этих, на первый взгляд крайних, точек зрения, при которой преимущественное проявление того или иного механизма торможения коррозии связано со степенью заполнения адсорбированными частицами корродирующей поверхности металла. [36]
Истинный механизм коррозии, вызываемой этими бактериями, остается невыясненным, но все сходятся на том, что первой ступенью в этом процессе является использование бактериями сульфатов воды с их превращением в сульфиды, которые затем при взаимодействии с водородом, выделяющимся на корродирующей поверхности металла, образуют сероводород. Таким образом, сульфатовосстанавливающие бактерии действуют как катодные деполяризаторы, удаляя скопившийся водород с катода и создавая условия для продолжения коррозионной реакции. Они предположили, что на некоторой стадии обмена веществ этих бактерий водородные атомы на катодных участках расходуются, способствуя восстановлению неорганических сульфатов в сульфиды. Вормвел и Фаррер [32] не вполне с этим согласны. Они считают, что уменьшаются как анодная, так и катодная поляризации Уменьшение анодной поляризации они объясняют следующей ступенью этого процесса, на которой получается сульфид железа, вероятно, в результате реакции между сероводородом и ферро-ионами, которые образуются на анодных участках. В связи с этим интерес представляет наблюдение, сделанное Адамсом и Фарре-ром [33], которые обнаружили, что присутствие ферро-ионов значительно увеличивает скорость коррозии чугуна сульфатовосста-навливающими бактериями. Продукты коррозии при наличии ферро-ионов проявляют тенденцию становиться рыхлыми, пористыми и хлопьевидными, в то время как в отсутствие ферро-ионов ( за исключением тех ферро-ионов, которые доставляются корродирующим металлом) продукты коррозии плотные, кристаллические и хорошо пристают к поверхности металла. [37]
Таким образом, электрохимическая коррозия металлов напоминает работу гальванического элемента, в котором отрицательный электрод ( например, цинк) растворяется, когда он соединен проводником со вторым электродом, на котором восстанавливаются ионы водорода или другие вещества 1, и поэтому ее можно рассматривать как результат работы большого числа коррозионных гальванических элементов на корродирующей поверхности металла, соприкасающейся с электролитом. [38]
Это происходит потому, что в условиях перемешивания практически отсутствуют диффузионные ограничения. Кислород беспрепятственно поступает к корродирующей поверхности металла. Беспрепятственно осуществляется и отвод продуктов коррозии. [39]
 |
Зависимость скорости коррозии стали в воде от времени при 40 С. [40] |
Коррозия, протекающая в присутствии угольной кислоты, приводит к загрязнению воды твердыми продуктами коррозии. Причиной непрочного сцепления окислов с корродирующей поверхностью металла является восстанавливающее и отслаивающее действие на окисные пленки образующегося атомарного и молекулярного водорода. [41]
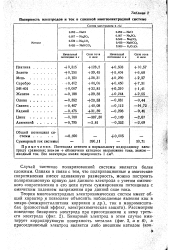 |
Полярность электродов и ток в сложной многоэлектродной системе. [42] |
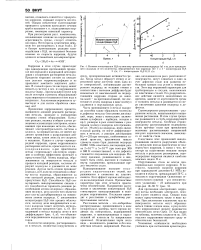
Рассмотрим поведение бинарного электрода при присоединении к нему третьего электрода ( фиг. Бинарный электрод в этом случае имитирует корродирующую поверхность металла ( фиг. [43]
В этом случае трещины развиваются в глубь корродирующей поверхности металла. Особенно сероводородному растрескиванию подвержены более прочные стали при превышении величины растягивающих напряжений нек-рого порогового значения, зависящего от свойств стали. [45]
Страницы: 1 2 3 4 5