Повышение - концентрация - электролит
Cтраница 1
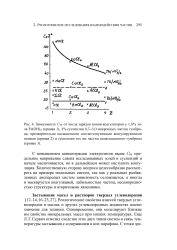
Повышение концентрации электролитов понижает К. Электролиты дегидратируют полиоксиэтиленовую цепь, что способствует образованию мицелл и повышает число молекул в мицелле. [1]
Повышение концентрации электролита в растворе или не влияет на адсорбцию радиоколлоидов, или слегка повышает ее. Адсорбция ионов в этом случае подчиняется закону действующих масе. [2]
Повышение концентрации электролита подавляет эту диссоциацию и смещает равновесие I II влево. Если это так, то как в ацетоне, так и в метаноле HPic при неполной диссоциации находится в двух равновесных формах. По данным [45], в интервале 10 - 25 С степень диссоциации увеличивается примерно в полтора раза. Но так как изменение энтальпии при таутомерном превращении зависит и от степени диссоциации а, а последняя с повышением температуры растет, то этот фактор действует в обратном направлении, делая Нт более эндотермичной. Сложные и разнонаправленные влияния изменений температуры и концентрации на отдельные эффекты, входящие в & Нт. [3]
С повышением концентрации электролитов выше CQ предельное напряжение сдвига исследованных золей и суспензий в начале увеличивается, но в дальнейшем может наступить коагуляция. Количественную сторону вопроса целесообразно рассмотреть на примере модельных систем, так как у реальных разбавленных дисперсных систем зависимость осложняется, а иногда и маскируется коагуляцией, лабильностью частиц, неоднородностью структуры и вторичными явлениями. [5]
С повышением концентрации электролитов количество мыла в ядровой фазе увеличивается, а в подмыльном клее уменьшается. [6]
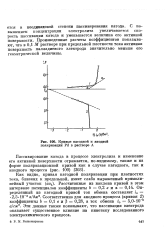 |
Кривые катодной и анодной поляризации Pd в растворе А. [7] |
С повышением концентрации электролита увеличивается скорость пассивации катода и уменьшается величина его активной поверхности. Произведенные расчеты коэффициентов показывают, что в 0 1 М растворе при предельной плотности тока активная поверхность палладиевого электрода значительно меньше его геометрической величины. [8]
С повышением концентрации электролита указанный изгиб закономерно смещается в сторону более высоких плотностей тока. Ниже этого изгиба осаждаются светлые блестящие палладиевые покрытия. [9]
С повышением концентрации электролита содержание недиссоциированных молекул увеличивается. При контакте с электролитом на поверхности полимера адсорбируются молекулы воды, ионы электролита, а также его недиссоциированные молекулы. Гидратирован-ные ионы большинства электролитов имеют больший размер, чем молекулы воды и недиссоциированные молекулы электролитов. [10]
С повышением концентрации электролита при постоянной температуре коэффициент d Hm / dT также должен станозиться менее отрицательным ( менее экзотермичным), так как предыдущие порции растворяемой соли до ГПГ играют по отношению к свободной воде как бы роль температуры, предразрушая ее структуру. Для хорошо растворимых в воде солей, вероятно, даже возможна перемена знака коэффициента при больших концентрациях. [11]
При повышении концентрации электролита часть противоионов переходит границу тп, причем толщина Qz диффузного слоя уменьшается. [12]
При повышении концентрации электролитов или при переходе к ионам более высоких зарядов, с одной стороны, размеры ионной атмосферы могут стать соизмеримыми с собственными размерами ионов, что делает неприменимым понятие ионной атмосферы, с другой стороны, уменьшение расстояния между ионами приведет к возникновению наряду с электростатическими иных по природе сил взаимодействия, например вандерваальсовских. Кроме того, диэлектрическая постоянная раствора в этих условиях значительно отличается от диэлектрической постоянной чистого растворителя. Рост сил межионного взаимодействия вызывает расхождение между теоретическими величинами, рассчитываемыми по уравнениям (1.26) и (1.27), и опытными данными. [13]
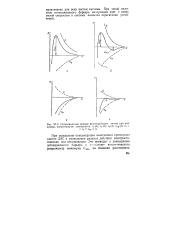 |
Потенциальные кривые взаимодействия частиц при различных концентрациях электролита. сг ( a. cz ( б. с3 ( в. скр ( г. ct. [14] |
При повышении концентрации электролита происходит сжатие ДЭС и уменьшение радиуса действия электростатических сил отталкивания. [15]
Страницы: 1 2 3 4