Повышение - концентрация - электролит
Cтраница 2
При повышении концентрации электролита распределение дитизона в водной фазе при постоянной аН уменьшается. [16]
При повышении концентрации электролита учет этого члена неоправдан. Изучение проводимости Nal и KI в различных растворителях показало [67], что эти соли в растворителе с высокой диэлектрической проницаемостью диссоциированы практически полностью ив теории зависимости проводимости от концентрации следует использовать значение среднего ионного диаметра а4 5 А. В растворителях с низкой диэлектрической проницаемостью заметна ионная ассоциация и параметр а, по-видимому, не имеет простого физического смысла. [17]
При повышении концентрации электролитов или при переходе к ионам более высоких зарядов, с одной стороны, размеры ионной атмосферы могут стать соизмеримыми с собственными размерами ионов, что делает неприменимым понятие ионной атмосферы, с другой стороны, уменьшение расстояния между ионами приведет к возникновению наряду с электростатическими иных по природе сил взаимодействия, например вандерваальсовских. Кроме того, диэлектрическая постоянная раствора в этих условиях значительно отличается от диэлектрической постоянной чистого растворителя. Рост сил межионного взаимодействия вызывает расхождение между теоретическими величинами, рассчитываемыми по уравнениям (1.26) и (1.27), и опытными данными. [18]
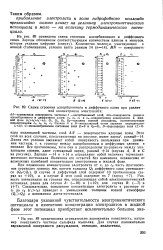 |
Схема строения адсорбционного и диффузного слоев при различной концентрации электролита. [19] |
Следовательно, повышение концентрации электролита в растворе от с до с2 ( cic2) приводит к уменьшению толщины ионной атмосферы ( QiQ2) и понижению дзета-потенциала. [20]
Как влияет повышение концентрации электролита в растворе на степень диссоциации. [21]
По мере повышения концентрации электролита добавляемая вода все больше подвергается действию ионов, участвуя в процессе вторичной гидратации в зонах, лежащих за пределами первичного гндратного комплекса. Это должно приводить к добавочному снижению ее теплоемкости. [22]
По мере повышения концентрации электролита добавляемая вода все больше подвергается действию ионов, участвуя в процессе вторичной гидратации в зонах, лежащих за пределами первичного гидратного комплекса. Это должно приводить к добавочному снижению ее теплоемкости. [23]
Этот последний с повышением концентрации электролита также должен становиться менее отрицательным, по причинам, подробно разобранным на стр. [24]
 |
Схема строения коллоидной мицеллы золя йодистого серебра. а - получаемого при избытке б - получаемого при избытке AgNO3. [25] |
Гун - Чапмена: повышение концентрации электролитов приводит к его сжатию, причем способность ионов сжимать диффузный слой возрастает с увеличением их валентности. [26]
Напомним, что с повышением концентрации электролита происходит поджатие диффузной атмосферы противоионов; при этом все большие доли падения потенциала приходятся на закрепленный ( малоподвижный) слой дисперсионной среды ж А, и соответственно идет уменьшение t - потенциала. [27]
Напомним, что с повышением концентрации электролита происходит поджатие диффузной атмосферы противоионов и все большие доли падения потенциала приходятся на закрепленный ( малоподвижный) слой дисперсионной среды х Д, что ведет к уменьшению - потенциала. [28]
Коэффициент активности уменьшается по мере повышения концентрации электролита и, наоборот, повышается при уменьшении его концентрации. В очень разбавленных растворах расстояние между разноименными ионами становится настолько большим, что силы их взаимного притяжения практически перестают действовать. [29]
Дальнейшая коагуляция ( гидрофобная) при повышении концентрации электролита приводит к возникновению компактных структур и расслаиванию системы. Вследствие предельного утоньшения и разрыва защитных прослоек возникают точечные непосредственные контакты между частицами, поэтому структуры, образовавшиеся в результате гидрофобной коагуляции, обычно более прочные, но хрупкие. Агрегация частиц в отличие от флокуляции обусловлена таким сжатием диффузных частей двойного электрического слоя, в результате которого сближаются параллельно расположенные пластины глинистых минералов, сокращается число структурообразующих элементов пространственного каркаса и уменьшается их суммарная поверхность контактных взаимодействий. Для дезагрегирования этих частиц используют приемы механического диспергирования. [30]
Страницы: 1 2 3 4