Повышение - электронная плотность
Cтраница 4
Гидроксильная группа, являясь заместителем первого рода, приводит к повышению электронной плотности в о - и n - положениях бензольного кольца. [46]
Реакции, характеризующиеся отрицательным параметром р, легче протекают при повышении электронной плотности на реакционном центре. Электронодонорные заместители ( например, - ОСНз) благоприятствуют таким реакциям, а электроноакцепторные заместители ( - NO2) затрудняют их ( разд. [47]
Следствием сопряжения свободной электронной пары гетероатома заместителя с - электронами кольца является повышение электронной плотности у атомов углерода в орто-и пара-положениях. [48]
Наличие электронодонорных метильных групп в а-положении по отношению к ацетальным связям вызывает повышение электронной плотности у связи С-О и увеличение ее чувствительности к электрофильным агентам, вызывающим разрыв цепи. Поэтому при введении ацетальдегидных групп в молекулярную цепь полиоксиметилена трудно рассчитывать на увеличение стабильности получающегося сополимера по сравнению с полиокснмети-леном. [49]
Сопряжение неподеленной пары электронов гидроксильной группы с я-электронами бензольного ядра приводит к повышению электронной плотности ядра преимущественно в орто - и пара-положениях и одновременно к повышению кислотности гидроксильной группы. [50]
Это можно объяснить тем, что метильная группа в re - положении вызывает повышение электронной плотности у атома азота N-аниона натриевой соли продукта присоединения, что приводит к усилению атаки азота на атом фосфора, и олефинирование протекает без нагревания. В случае о-изомера дефосфонирования в тех же условиях не происходит из-за пространственного влияния метильной группы, которое, по-видимому, проявляется в понижении нуклеофильности N-аниона. [51]
Мезомерный эффект называется положительным ( М), если его действие приводит к повышению электронной плотности на реакционном центре, и наоборот В приведенных ниже примерах реакционным центром является двойная углерод-углеродная связь. [52]
Бактери-цидность соединений возрастает с увеличением числа непредельных связей в алифатическом радикале и с повышением электронной плотности заряда у четвертичного атома азота. [53]
Элиминирование аниона CH2CN -, которому способствует возможность делокализации отрицательного заряда в анионе и повышение электронной плотности на атоме фосфора после переноса первого электрона, создает возможность дальнейшего восстановления при том же потенциале. Естественно, что введение второй метиленовой группы ( т 2) препятствует элиминированию. [54]
Для n - фторфенильных соединений ( VI) основная резонансная структура, которая приводит к повышению электронной плотности в пара-поло-жении бензольного кольца, включает перекрывание заполненных 5dxy - орбиталей платины с рядом расположенной ря-орбиталью углерода. [55]
Сильная обратная подача электронов от металла к олефиновому лиган-ду, как можно полагать, должна способствовать повышению электронной плотности на углеродных атомах координированной двойной связи в комплексах металлов в низком состоянии окисления и облегчать атаку электрофильных реагентов. Несмотря на то, что реакции координированного лиганда в комплексах нульвалентных металлов изучены пока очень мало, однако в ряде случаев найдены примеры, подтверждающие это положение. Все обнаруженные случаи относятся к реакциям окислительного присоединения. [56]
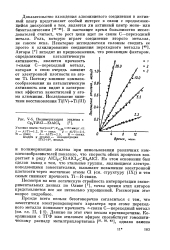 |
Полимеризация этилена с Cp2TiRCl - EtAlCl2. [57] |
На этом основании был сделан вывод о том, что этильные группы, являющиеся электро-ноподающими заместителями, вызывают повышение электронной плотности через мостичные атомы С1 ( см. структуру ( IX)) и тем самым снижают прочность Ti-R - связи. [58]
Страницы: 1 2 3 4