Повышение - адсорбция
Cтраница 1
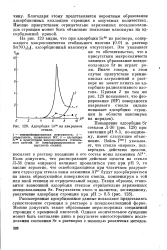 |
Адсорбция Sr90 на кварцевом стекле. [1] |
Повышение адсорбции Sr стеклом Л-36 ( рис. 128) при значении рН 8.5, по-видимому, имеет следующее объяснение. [2]
 |
Расположение адсорбированных молекул в поверхностном слое. [3] |
При повышении адсорбции, как это было показано А. Н. Фрум-киным, по аналогии с уравнением трехмерного состояния следует в уравнение ( 4) ввести поправки на силы молекулярного сцепления в адсорбционном слое и на площадь, занимаемую адсорбированными молекулами. [4]
При повышении адсорбции, как это было показано А. Фрумкиным, по аналогии с уравнением трехмерного состояния следует в уравнение ( 4) ввести поправки на силы молекулярного сцепления в адсорбционном слое и на площадь, занимаемую адсорбированными молекулами. [5]
В литературе имеются данные о повышении адсорбции водорода, кислорода, азота, аргона, аммиака, этилена, углекислого газа, окиси углерода и сероводорода силикагелем после его облучения Лучами. [6]
С ростом рН раствора КМЦ одновременно с повышением адсорбции увеличивается объем ранее гидратированной глины. Однако происходит это не в результате пептизации глинистых частиц под действием щелочи ( аналогичная зависимость адсорбции КМЦ и роста объема имеет место и в случае предварительного набухания глины в 0 3 % - ном растворе щелочи), а в результат большей толщины адсорбционного слоя по сравнению с гидратным. Исследования адсорбции в зависимости ог концентрации КМЦ ( рН 9 5 - - 9 6) на гидратированном огланлинском бентоните показали, что наиболее интенсивно адсорбция растет при концентрациях до 0 5 % и затем кривая зависимости выполаживается. В интервале концентраций от 1 0 до 2 0 % она практически параллельна оси концентраций. [7]
Карбоксильная группа и галогены в алифатических соединениях способствуют повышению адсорбции. При адсорбции молекулы ПАВ в пограничном слое ориентируются таким образом, что свободная энергия поверхностного слоя снижается. Очевидно, что адсорбция при этом зависит не только от природы адсорбента, но и растворителя и адсорбируемого вещества. Согласно правилу уравнивания полярностей, ПАВ должны адсорбироваться в поверхности раздела твердое тело - жидкость тем лучше, чем больше между ними разность полярностей. При этом своей полярной частью молекулы обращены к поверхности адсорбента, если она гидрофильна, углеводородной же частью - в сторону неполярного или малополярного растворителя и наоборот - для системы гидрофобный адсорбент - полярный растворитель. [8]
Было также установлено, что добавка силиката в водную среду способствует повышению адсорбции додецилбензолсульфоната ( сульфонол НП) на металле. Был сделан вывод о полимолекулярной адсорбции молекул додецилбензолсульфоната с ориентацией гидрофильных групп в наружном слое в сторону водной фазы. [9]
 |
Изменение объема жидкости в капиллярах в зависимости от влажности атмосферы. [10] |
Увеличение относительной поверхности соприкосновения жидкости с поверхностью сосуда приводит, наряду с повышением адсорбции вещества из раствора стенками сосуда и скорости испарения жидкости, к увеличению поверхностного натяжения, достигающего большого значения при работе с капиллярами. Это обстоятельство приходится учитывать при разработке техники эксперимента ультрамикрометода. Так, поверхностное натяжение необходимо преодолевать при перенесении жидкости из капилляра в капилляр. В то же время устойчивое вследствие действия поверхностного натяжения положение мениска создает благоприятные условия для точной дозировки растворов. [11]
Кажется аномальным тот факт, что добавление NaCl при рН 5 9 вызывает повышение адсорбции ПЭО, хотя известно, что добавление соли увеличивает концентрацию заряженных центров на поверхности кремнезема и, следовательно, должно понижать возможность образования водородных связей. Но при рН - 11 концентрация противоионов - катионов Na - на поверхности или вблизи нее становится настолько большой, что полностью предотвращает адсорбцию ПЭО. [12]
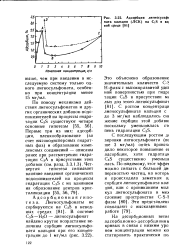 |
Адсорбция лигносульф ната кальция ( ЛСК на C2S в во. иой среде ( 81 ]. [13] |
С последующим ростом д зировки лигносульфоната ( вь ше 3 мг / мл) опять происхс дило некоторое повышение ег адсорбции, хотя гидратаци CaS существенно уменыш лась. [14]
В ряду близких по строению поверхностно-активных веществ тормозящее действие на одну и ту же электрохимическую реакцию возрастает с повышением адсорбции этих веществ. Гирст и сотрудники [92] показали, что между логарифмом формальной скорости электрохимической реакции восстановления плюмбат-иона на фоне 1 0 М раствора NaOH в насыщенных растворах ряда хлор - и алкилпроизводных пиридина и величиной снижения поверхностного натяжения на границе ртуть - раствор в тех же растворах при одном и том же потенциале имеется приблизительно линейная зависимость. [15]
Страницы: 1 2 3 4