Подвижность - ион - водород
Cтраница 2
Каталитическая активность веществ не связана и с подвижностью ионов водорода: тщательные исследования [739] показали, что органические соединения, имеющие весьма подвижный водород, каталитической активностью не обладают. [16]
 |
Графики зависимости удельной электропроводности от концентрации при 18 С. [17] |
Согласно данным, приведенным в табл. 17.2, подвижность ионов водорода и гидроксильной группы при бесконечном разбавлении в 2 - 8 раз выше, чем подвижность остальных ионов. Этим объясняется высокая электропроводность кислот и щелочей. [18]
Естественно, что при таком механизме проводимости скорость, а следовательно и подвижность иона водорода оказываются значительно больше, чем у ионов, просто движущихся в электрическом поле. [19]
Такое различие связано с тем, что подвижность гидроксил-ионов меньше, чем подвижность ионов водорода. [20]
Поскольку направленное протекание католита через диафрагму недостаточно для подавления встречного электропереноса катионов Н ( подвижности ионов водорода и железа различаются в 5 - 6 5 раз [11 ]), повышение кислотности анолита сверх допустимой, даже в случае электролиза подкисленных растворов на катоде, не имеет места. Если к тому же принять во внимание, что при осуществлении последнего мероприятия обслуживание электролизера значительно упрощается ( в частности, отпадает необходимость в периодической замене катодов) и представляется возможным работать с уменьшенным на одну треть расходом железного купороса при сниженном ( за счет увеличения электропроводности католита и сокращения межэлектродного расстояния) напряжении на электролизере, вариант с катодным разложением кислоты кажется более предпочтительным. [21]
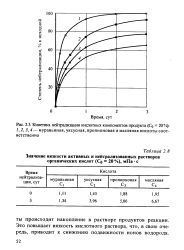 |
Кинетика нейтрализации кислотных компонентов продукта ( Со 20 %. 7 2 3, 4 - муравьиная, уксусная, пропионовая и масляная кислоты соответственно. [22] |
Это повышает вязкость кислотного раствора, что, в свою очередь, приводит к снижению подвижности ионов водорода. [23]
При значительном увеличении давления молекулярные рои в воде должны исчезать, однако при этом не наблюдается уменьшения подвижности иона водорода, как следовало бы ожидать на основании рассмотренной схемы. Из этого видно, что мы пока не имеем бесспорного объяснения для ненормально высокой подвижности иона водорода. [24]
 |
Схема установки для измерения электропроводности растворов. [25] |
Поскольку протон в молекуле воды связан прочнее, чем в Н3О, то подвижность гидроксид-иона меньше, чем подвижность ионов водорода. [26]
Незначительная роль диффузионных ограничений в кинетике катодного выделения водорода из кислых растворов становится понятной, если учесть, что подвижность ионов водорода больше подвижности всех других ионов. При выделении водорода из щелочных растворов концентрационная поляризация должна быть низка, благодаря очень высокой концентрации разряжающихся частиц молекул воды. [27]
Незначительная роль диффузионных ограничений в кинетике катодного выделения водорода из кислых растворов становится понятной, если учесть, что подвижность ионов водорода значительно больше подвижности всех других ионов. [28]
Незначительная роль диффузионных ограничений в кинетике катодного выделения водорода из кислых растворов - становится понятной, если учесть, что подвижность ионов водорода значительно больше подвижности всех других ионов. [29]
Так как протон в молекуле воды связан более прочно, чем в ионе гидроксония, то подвижность гидроксид-иона оказывается ниже, чем подвижность иона водорода. [30]
Страницы: 1 2 3 4