Подвижность - ион - водород
Cтраница 3
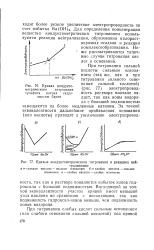 |
Кривая кондукто-метрического титрования сульфата натрия гидроокисью бария.| Кривые кондуктометрического титрования в реакциях нейтрализации. [31] |
Восходящий за точкой эквивалентности участок кривой имеет меньший угол наклона по сравнению с нисходящим, так как подвижность гидроксил-ионов меньше, чем подвижность ионов водорода. [32]
Так как протон в молекуле воды связан более прочно, чем в ионе гидроксония, то подвижность иона гидроксила оказывается ниже, чем подвижность иона водорода. [33]
При титровании сильных оснований сильными кислотами различие заключается в том, что до точки эквивалентности электропроводность раствора понижается менее резко, так как подвижность ионов ОН - меньше подвижности ионов водорода. В то же время избыток титранта вызывает более резкое увеличение электропроводности. [34]
Полный обмен катионов вводимых электролитов на ион водорода К-4 заканчивается в точке перехода криволинейного участка кривой х - С в прямолинейный, за которым рост электропроводности с увеличением концентрации электролита идет с меньшей скоростью, так как подвижность других ионов гораздо ниже, чем подвижность ионов водорода. [35]
Удельная электропроводность чистой воды равна 4 1Q - 8 ом-1 см-1 при 18 С. Подвижность иона водорода равна 315 см2 - ом-1 - г-экв-1 и иона гидроксила-174 см2 - ом-1 - г-экв-1. [36]
Способность раствора образовывать ионы водорода или гидроксильные ионы оценивается по его электропроводности ( стр. Поскольку подвижность ионов водорода и гидроксильных ионов значительно больше, чем у остальных катионов и анионов, причем они мало отличаются друг от друга ( см. стр. [37]
В жидких пленках подвижность ионов водорода остается неизменной. [38]
Есть еще один фактор, от которого зависит электропроводность - это подвижность ионов; мерой подвижности служит скорость движения иона в поле с падением потенциала 1 в / см. Подвижность связана с природой иона, и уже в жидких средах, как было доказано прямым опытом, ион водорода оказывается самым быстрым. В кристаллической решетке льда подвижность иона водорода, очевидно, возрастает и делается в сотни и тысячи раз большей, чем в воде. [39]
Максимальные диффузионные потенциалы наблюдаются в тех случаях, когда один из растворов - кислота. Это объясняется тем, что подвижность ионов водорода, присутствующих в растворе кислоты ( в данном случае в растворе хлористого водорода), превосходит подвижности всех других ионов. [40]
Известны фазы с ион-юй проводимостью, обусловленной подвижностью ионов водорода, лития, натрия, калия, рубидия, цезия, меди, серебра, магния, кальция, стронция, бария, свинца, кислорода, фтора, хлора, брома и иода. [41]
Максимальные диффузионные потенциалы наблюдаются в тех случаях, когда один из растворов - кислота. Это становится понятным, если вспомнить, что подвижность ионов водорода присутствующих в растворах кислот ( в данном случае в растворе хлористого водорода) значительно превосходит подвижности всех других ионов. Из табл. 32 видно, что расхождение между опытными и вычисленными значениями диффузионных потенциалов хотя и невелико, все же достигает нескольких тысячных вольта и превосходит возможные ошибки опыта. Поэтому пользоваться уравнениями ( VI-40) и ( VI-43), а также общим уравнением ( VI-39) при точных расчетах диффузионных потенциалов не рекомендуется. [42]
Последнее предположение может выполняться при сравнительно небольших концентрациях соли в растворе, что обычно имеет место при измерениях окислительного потенциала. К тому же в растворителях с малой диэлектрической проницаемостью подвижности ионов водорода и аниона отличаются по величине значительно меньше, чем в водных растворах. [43]
Согласно теории диффузионного потенциала это предположение является строгим только для водных растворов. Тем не менее, Винн-Джонс ( частное сообщение) установил, что подвижность иона водорода в некоторых смешанных растворителях ( включая водные растворы перекиси водорода) заметно не отличается от подвижностей других катионов. Стрелов [59] пришел к аналогичному заключению при изучении электропроводности соляной кислоты в водно-мета-нольных растворах. [44]
Такой механизм переноса протона [ схема ( 10) 1 объясняет приблизительно на 80 % подвижность иона водорода в воде. [45]
Страницы: 1 2 3 4