Закись - таллий
Cтраница 4
Свободный таллий - металл голубовато-серого цвета, ковкий, режется ножом. В сухом воздухе стоек, во влажном быстро покрывается серой пленкой окиси. Непосредственно реагирует с водой, образуя растворимый в воде гидрат закиси таллия - Т1ОН; реагирует с кислотами, особенно активно с азотной кислотой. [46]
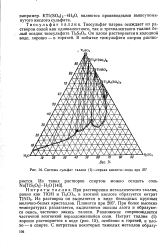 |
Система сульфат таллия ( I-серная кислота-вода при 25. [47] |
При растворении металлического таллия равно как ТЮН и Т12СО3, в азотной кислоте образуется нитрат TINOs. Из растворов он выделяется в виде безводных крупных молочно-белых кристаллов. При более высоких температурах разлагается, выделяются окислы азота и образуются окись, частично закись таллия. Разложение сопровождается частичной возгонкой неразложившейся соли. Нитрат таллия ( I) хорошо растворяется в воде ( рис. 15), особенно в горячей, и плохо - в спирте. [48]
Она плавится при 300 и разъедает стекло. Закись таллия легко окисляется до окиси Т12О3 или восстанавливается до металла. Четырехокись таллия Т12О4 может быть получена электролитически. При растворении в воде закиси таллия происходит образование гидрата закиси. [49]
Соединения закиси таллия бесцветны и большинство из них растворимо в воде. Сульфид, хлорид, бромид, иодид и хромат в воде не растворимы. Закись таллия представляет собой темный порошок; ее водный раствор имеет щелочную реакцию и с жадностью поглощает двуокись углерода из воздуха. Кипячение с азотной кислотой не окисляет соли закиси таллия, но при действии царской водки, хлора и брома происходит окисление их в соли трехвалентного таллия. [50]
Страницы: 1 2 3 4