Энергетический подуровень
Cтраница 3
Электроны стабилизированного ( достроенного до 10 электронов при двух электронах на подуровне ns) ( п - l) d - энергетического подуровня при возбуждении атомов не распариваются и не влияют на валентные свойства рассматриваемых элементов. [31]
Электроны стабилизированного ( достроенного до 10 электронов при двух электронах на подуровне ns) ( п - 1) d - энергетического подуровня при возбуждении атомов не распариваются и не влияют на валентные свойства рассматриваемых элементов. [32]
Принцип действия квантовых преобразователей основан на выделении частоты поглощения или испускания электромагнитной энергии при переходе атомов рабочего вещества с одного подуровня на другой энергетический подуровень, расстояние между которыми, а следовательно, и частота перехода зависят от величины внешнего магнитного поля. [33]
Считается, что когда электрон любого квантового слоя вращается по орбите, определяемой значением / 0, он находится в s - состоянии и занимает энергетический подуровень s данного квантового слоя. В первом квантовом слое s - состояние отвечает круговой орбите. [34]
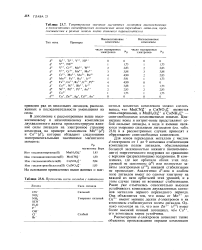 |
Теоретические значения магнитных моментов высокоспиновых и низкоспиновых октаэдрических комплексных ионов переходных металлов, предсказываемые в рамках модели чисто спинового парамагнетизма. [35] |
Для ионов переходных металлов с числом d - электронов от 1 до 9 возможна стабилизация комплексов полем лигандов, обусловленная большей заселенностью нижнего ( несвязывающего) энергетического подуровня по сравнению с верхним ( разрыхляющим) подуровнем. В комплексах, где все орбитали обоих этих подуровней не заполнены ( d) или полностью заняты электронами ( d10), никакой стабилизации не происходит. Аналогично 5-ион в слабом поле лигандов имеет по одному электрону на каждой из пяти орбиталей этих уровней, и в этом случае также не возникает стабилизации. [36]
Что касается дырок, то они упорядочение движутся по направлению приложенного напряжения, приобретая добавочную энергию, соответствующую этому напряжению, и беспрепятственно переходя с одного на другой энергетический подуровень широкой валентной зоны. [37]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. [38]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома - максимально. [39]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. [40]
Электронные формулы атомов изображаются с помощью двух квантовых чисел: п - главного квантового числа, указывающего энергетический уровень электрона, и / - орбитального квантового числа, указывающего энергетический подуровень электрона. [41]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой прав и л ом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. [42]
В атомах бериллия, бора, углерода может происходить разделение электронных пар за счет перехода электронов с 2з - под-уровня на 2р - подуровень, так как в атомах этих элементов на 2р - подуровне имеются вакантные орбитали. Такой переход на более высокий энергетический подуровень внутри данного энергетического уровня не требует больших затрат энергии, может быть скомпенсирован за счет образования химической связи и осуществляется в условиях обычных химических реакций. [43]
 |
Последовательность застройки электронами энергетических уровней и подуровней в оболочке изолированного атома в нормальном ( невозбужденном состоянии ( принципиальная схема. [44] |
Коэффициенты при буквенных обозначениях подуровней указывают на главные квантовые числа соответствующих уровней, прочеркнутые графы - на отсутствие соответствующих подуровней на данном уровне. Они приведены в верхней части каждой клетки, символизирующей энергетический подуровень. Подуровни, постепенно формирующие данный период, соединены стрелками. [45]
Страницы: 1 2 3 4