Закон - рауль
Cтраница 2
 |
Связь осмотического давления с давлением насыщенного пара. [16] |
Закон Рауля вполне справедлив для предельно разбавленных растворов неэлектролитов. Как правило, по мере повышения концентрации возникают отклонения от него, различающиеся как по величине, так и по знаку. [17]
Закон Рауля можно обосновать и теоретически, если принять, что силовые поля молекул растворителя и растворенного вещества в растворе одинаковы и появление последнего в растворе не вносит во взаимодействие между молекулами никаких изменений. [18]
 |
Парциальное и общее давление паров идеальной бинарной смеси двух летучих жидкостей. [19] |
Закон Рауля соблюдается тем точнее, чем разбавленнее раствор. По мере ППВЫШРНИЯ концентрации в большинстве растворов влзлш a т oткл5HJei те JИL идeaльнoгo состояния, особенно в растворах солей, кислот и оснований, где различия становятся значительными даже в разбавленных растворах. Эти особенности поведения указанной категории растворов связаны с электролитической диссоциацией растворенного вещества. [20]
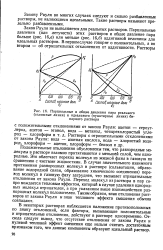 |
Парциальные и общее давления пара реального ( сплошные линии и идеального ( пунктирные линии бинарного раствора. [21] |
Закон Рауля не выполняется для реальных растворов. [22]
Закон Рауля, связывающий давление пара растворителя над раствором и концентрацию растворенного вещества, может быть использован для определения молекулярного веса растворенного вещества. [23]
Закон Рауля в широком интервале концентраций хорошо выполняется только для молекул с близкими структурами, например бензола и толуола. [24]
Закон Рауля выглядит достаточно простым, но с молекулярной точки зрения он часто вызывал недоумения: можно ли допустить, что относительное понижение упругости пара зависит только от мольной доли, но не от природы второгв компонента, когда размеры молекул обоих компонентов сильно отличаются. [25]
Закон Рауля, связывающий давление пара растворителя над раствором и концентрацию растворенного вещества, может быть использован для определения молекулярного веса растворенного вещества. [26]
 |
Зависимость общего. [27] |
Закон Рауля выполняется тогда, когда присутствие молекул В не влияет на взаимодействие между молекулами А. Давление пара РА при этом зависит от сил взаимодействия между молекулами А и от их количества в растворе. [28]
 |
Графическое выражение закона Рауля. [29] |
Закон Рауля позволяет выразить связь между давлением пара совершенного бинарного раствора и его составом в виде простого уравнения. [30]
Страницы: 1 2 3 4