Закон - рауль
Cтраница 4
Закон Рауля иллюстрирован диаграммой ( рис. 3), представляющей зависимость давления насыщенного пара двухкомпонентной смеси жидкостей А и В от ее состава. На отрезке АВ отложены мольные доли обеих жидкостей. [46]
Закон Рауля может быть сформулирован также но отношению к мольной доле растворителя. [47]
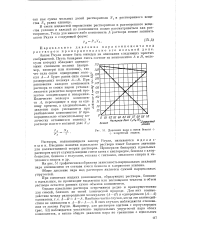 |
Давление пара в смеси бензол - f РА 1 - - хлористый этилен. [48] |
Закон Рауля может быть выведен на основании следующих простых соображений. Пусть бинарная смесь состоит из компонентов А и В, молекулы которых обладают одинаковыми силовыми полями ( например, изомеры или изотопы), так что сила связи однородных моле - кул А-А будет равна силе связи gr разнородных молекул А-В. [49]
Закон Рауля гласит, что парциальное давление пара каждого компонента в паровой смеси над кипящей при какой-либо температуре жидкой смесью равно давлению насыщенного пара этого компонента, кипящего в чистом виде при той же температуре, умноженному на молекулярную долю этого компонента в жидкой смеси. [50]
Закон Рауля можно сформулировать также следующим образом: давление пара растворителя в растворе прямо пропорционально мольной доле растворителя. [51]
Закон Рауля следует из зависимости ( V. [52]
Закон Рауля ( уравнение 30) и закон Вант-Гоффа ( см. уравнение 37) справедливы только для разбавленных растворов неэлектролитов. Концентрированные растворы и растворы электролитов обнаруживают значительные отклонения от этих закономерностей. [53]
Закон Рауля, следовательно, можно сформулировать таким образом: парциальное давление компонента в паре пропорционально молярной доле этого компонента в жидкости, а коэффициент пропорциональности равен упругости насыщенного пара чистого компонента. Ввиду пропорциональности между р и х уравнениям ( 12 - 22) и ( 12 - 23) на диаграмме р - х ( рис. 12 - 13) отвечают прямые линии. [54]
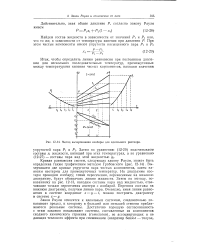 |
Метод вычерчивания изобары для идеального раствора. [55] |
Закон Рауля относится к идеальным системам, следовательно показывает предел, к которому в большей или меньшей степени приближаются реальные системы. Достаточно хорошую согласованность с этим законом показывают системы, составленные из компонентов сходного химического строения ( гомологов), не ассоциирующих и не дающих теплового эффекта при смешивании ( например бензол - толуол. [56]
Закон Рауля выглядит достаточно простым, но с молекулярной точки зрения он часто вызывал недоумение: можно ли допустить, что относительное понижение давления пара зависит только от мольной доли, но не от природы второго компонента, когда размеры молекул обоих компонентов сильно отличаются. Однако ответ здесь также прост: смеси веществ, сильно различающихся по размеру молекул, не обладают свойствами идеальных растворов и для них закон Рауля не выполняется. [57]
Страницы: 1 2 3 4