Закон - действие - масса
Cтраница 2
Закон действия масс, справедливый для растворов слабых электролитов, становится применимым к растворам сильных электролитов, если под действующими массами понимать именно активность ионов. [16]
Закон действия масс, справедливый для растворов слабых электролитов, не применим к растворам сильных электролитов. [17]
Закон действия масс применим для процесса диссоциации воды. [18]
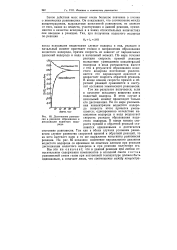 |
Достижение равнове - скорость реакции образования йодистого водорода. В конце концов скорости прямой и обратной реакций становятся одинаковыми и достигается. [19] |
Закон действия масс имеет очень большое значение в учении о химических равновесиях. Он показывает, что соотношение между концентрациями, выражаемое константой равновесия, не зависит от того, какие из веществ, участвующих в данной реакции, применяются в качестве исходных и в каких относительных количествах они введены в реакцию. [20]
Закон действия масс позволяет решать вопрос о том, как изменится скорость реакции при изменении концентрации всех или некоторых веществ, участвующих в ней. [21]
Закон действия масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Часто уравнение реакции не отражает ее механизма. [22]
Закон действия масс является одним из наиболее важных обобщающих законов, иапользуемых аналитической химией. [23]
Закон действия масс в его классической форме применим только к неэлектролитам и слабым электролигам в разбавленных водных растворах. [24]
Закон действия масс позволяет устанавливать условия наиболее выгодного течения реакций. При действии хлора на преххлористый фосфор на холоду образуется твердый пятихлористый фосфор. Если это вещество нагреть, оно расщепляется на свои исходные компоненты. [25]
Закон действия масс имеет важное значение в химии. [26]
Закон действия масс, которому отвечает приведенное уравнение, был подтвержден Вант-Гоффом 4 ( 1877) на основе термодинамических соображений. Он исходил из положения, что каждое превращение, обратимое при постоянной температуре, производит определенное количество работы, зависящее от начальной и конечной стадий, но не зависящее от промежуточных ступеней, через которые оно протекает. Это положение известно как закон Гесса. В 1869 г. Август Фридрих Горстман ( 1842 - 1929) обратил внимание химиков на тот факт, что в химических реакциях тепловой эффект и сродство часто практически совпадают друг с другом. Иные пути были избраны в работах по определению удельных коэффициентов сродства различных веществ. Один из таких путей, основанный на объемных и оптических методах, использовал Оствальд 5, который определял относительные удельные коэффициенты сродства из пропорций, в которых основание соединяется с несколькими кислотами в смеси. [27]
Закон действия масс помогает найти условия, при которых из раствора будет выкристаллизовываться карналлит. [28]
Закон действия масс в применении к ионизации слабых электролитов может быть выражен еще другим путем. [29]
Закон действия масс может быть выведен на основе следующего положения теории вероятности: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого события. [30]
Страницы: 1 2 3 4