Газовый закон
Cтраница 1
Газовый закон используют для приведения объемной скорости потока к, условиям, существующим в колонке, как описано в гл. IV, и для вычисления поправки на изменение объемов при программировании температуры, как описано в гл. В случае паров, отклонение от идеальности учитывается введением в расчеты фугитивности. [1]
Газовый закон используют для приведения объемной скорости потока к условиям, существующим в колонке, как описано в гл. IV, и для вычисления поправки на изменение объемов при программировании температуры, как описано в гл. В случае паров, отклонение от идеальности учитывается введением в расчеты фугитивности. [2]
Химический газовый закон Гей-Люссака не уточняет, в виде каких частиц ( атомов или молекул) участвуют одноэлементные газы в реакциях. В то время считалось, что газы состоят из атомов, а поскольку размеры атомов различных газов неодинаковы, то и число атомов в равных объемах различных газов должно быть разным; это явно противоречило экспериментальным наблюдениям Гей-Люссака. В дальнейшем это противоречие было снято, поскольку обнаружилось, что многие газы ( водород, кислород, хлор и др.) состоят из двухатомных молекул. [3]
Подобно газовым законам уравнение Клапейрона - Менделеева является урав-состояния идеального газа и для реальных газов выполняется приближенно на сравнительно небольших интервалах температур и давлений. [4]
Подобно газовым законам уравнение Клапейрона - Менделеева является уравнением состояния идеального газа и для реальных газов выполняется приближенно на сравнительно небольших интервалах температур и давлений. [5]
Основным газовым законам точно подчиняются только так называемые идеальные газы. Поведение реальных газов несколько отличается от поведения идеальных газов, и тем сильнее, чем ниже температура и чем больше давление. [6]
Согласно газовым законам Гей-Люссака и Шарля при температуре абсолютного нуля объем v и давление р таза должны были бы обращаться в нуль. Однако эти законы получены из опытов с газами при температурах, еще далеких от абсолютного нуля, поэтому такая экстраполяция была бы незакономерной. Действительно, по мере приближения к абсолютному нулю все газы переходят вначале в жидкое, а затем и в твердое состояние и, таким образом, газовые законы становятся вообще неприменимыми. [7]
 |
I Константы газового закона. [8] |
Этот газовый закон является общим для любпх газов. Коэффициент сжимаемости является функцией температуры, давления и состава газа и выражается в зависимости от этих переменных графически или аналитически. [9]
Третий газовый закон, получивший название закона А. Авогадро, открыт в 1811 г. Он формулируется следующим образом: при одинаковом давлении и одинаковой температуре одинаковые объемы разных газов содержат одинаковое число молекул. [10]
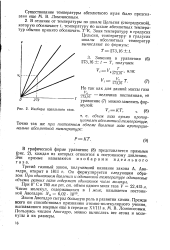 |
Изобары идеального газа. [11] |
Третий газовый закон, получивший название закона А. Аво-гадро, открыт в 1811 г. Он формулируется следующим образом: При одинаковом давлении и одинаковой температуре одинаковые объемы разных газов содержат одинаковое число молекул. [12]
 |
Константы газового закона. [13] |
Этот газовый закон является общим для любпх газов. Коэффициент сжимаемости является функцией температуры, давления и состава газа и выражается в зависимости от этих переменных графически или аналитически. [14]
Из газовых законов вытекает один неожиданный вывод. Определеннее количество тяжелых молекул, находящихся в данном объеме и при данной температуре, оказывает то же самое давление, какое оказывает такое же количество легких молекул, находящихся в таком же объеме и при той же температуре. Таким образом, давление не зависит нп от массы молекул газа, ни от их природы, а зависит только от их числа. [15]
Страницы: 1 2 3 4